Giải bài tập Hóa học 9, Bài 32: Luyện tập chương 3: Phi kim – sơ lược bảng tuần hoàn các nguyên tố hóa học.
2019-07-03T23:38:01-04:00
2019-07-03T23:38:01-04:00
Giải bài tập Hóa học 9, Bài 32: Luyện tập chương 3: Phi kim – sơ lược bảng tuần hoàn các nguyên tố hóa học.
/themes/cafe/images/no_image.gif
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Thứ tư - 03/07/2019 04:15
Giải bài tập Hóa học 9, Bài 32: Luyện tập chương 3: Phi kim – sơ lược bảng tuần hoàn các nguyên tố hóa học.
Bài 1. Căn cứ vào sơ đồ 1, hãy viết các phương trình hóa học với phi kim cụ thể là lưu huỳnh.
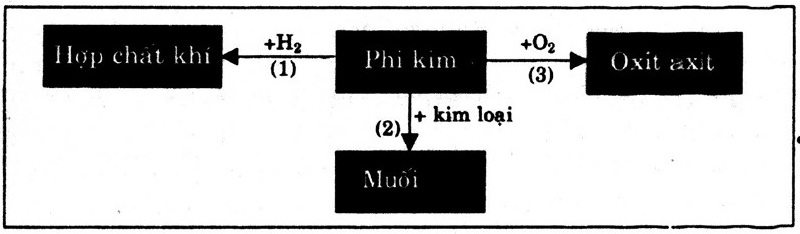 Hướng dẫn giải:
S + H2 → H2S (1)
S + Fe → FeS (2)
S + O2 → SO2 (3)
Bài 2. Hãy viết các phương trình hóa học biểu diễn tính chất hóa học của clo theo sơ đồ 2.
Hướng dẫn giải:
S + H2 → H2S (1)
S + Fe → FeS (2)
S + O2 → SO2 (3)
Bài 2. Hãy viết các phương trình hóa học biểu diễn tính chất hóa học của clo theo sơ đồ 2.
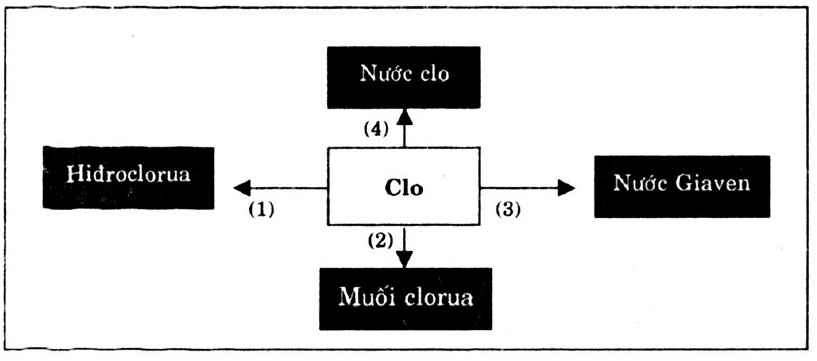 Hướng dẫn giải:
Các phương trình hóa học
H2 + Cl2 → 2HCl (1)
2Na + Cl2 → 2NaCl (2)
2NaOH + Cl2 → NaCl + NaClO + H2O (3)
H2O + Cl2 → HC1 + HClO (4)
Bài 3. Hãy viết các phương trình hóa học biểu diễn tính chất hóa học của cacbon và một số hợp chất của nó theo sơ đồ 3. Cho biết vai trò của cacbon trong các phản ứng đó.
Hướng dẫn giải:
Hướng dẫn giải:
Các phương trình hóa học
H2 + Cl2 → 2HCl (1)
2Na + Cl2 → 2NaCl (2)
2NaOH + Cl2 → NaCl + NaClO + H2O (3)
H2O + Cl2 → HC1 + HClO (4)
Bài 3. Hãy viết các phương trình hóa học biểu diễn tính chất hóa học của cacbon và một số hợp chất của nó theo sơ đồ 3. Cho biết vai trò của cacbon trong các phản ứng đó.
Hướng dẫn giải:
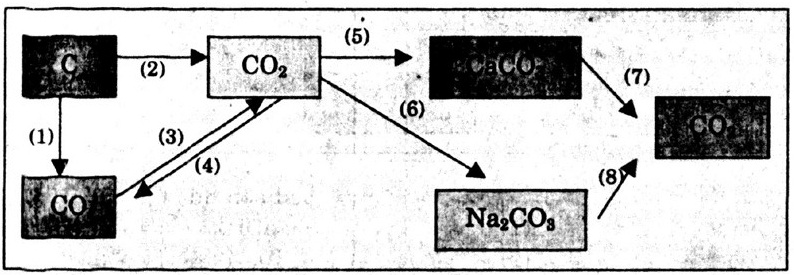 Các phương trình hóa học
2C + O2
Các phương trình hóa học
2C + O2  2CO (1)
C + O2 → CO2 (2)
2CO + O2 → 2CO2 (3)
CO2 + C → 2CO (4)
CO2 + CaO → CaCO3 (5)
CO2 + 2NaOH → Na2CO3 + H2O (6)
CaCO3
2CO (1)
C + O2 → CO2 (2)
2CO + O2 → 2CO2 (3)
CO2 + C → 2CO (4)
CO2 + CaO → CaCO3 (5)
CO2 + 2NaOH → Na2CO3 + H2O (6)
CaCO3 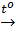 CO2↑ + CaO (7)
Na2CO3 + 2HCl → CO2↑ + 2NaCl + H2O (8)
Bài 4. Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm 1 trong bảng tuần hoàn các nguyên tố hóa học. Hãy cho biết:
- Cấu tạo nguyên tử của A.
- Tính chất hóa học đặc trưng của A.
- So sánh tính chất hóa học của A với các nguyên tố lân cận.
Hướng dẫn giải:
- A là Na, có 3 lớp electron : 2, 8, 1
- Tính chất hóa học đặc trưng là tính kim loại.
- Tính kim loại của Na mạnh hơn của Mg (12) và Li (3)
- Tính kim loại của Na yếu hơn của K (19)
Bài 5.
a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32gam
oxit sắt này tác dụng hoàn toàn với khí cacbon oxỉt thì thu được 22,4 gam chất rắn.
b) Chất khí sinh ra được hấp thụ hoàn toàn bằng dung dịch tước vôi trong dư. Tính khối lượng kết tủa thu được.
Hướng dẫn giải:
a) Trong 32 g FexOy có 32 - 22,4 = 9,6g oxi
Ta có tỷ số x : y =
CO2↑ + CaO (7)
Na2CO3 + 2HCl → CO2↑ + 2NaCl + H2O (8)
Bài 4. Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm 1 trong bảng tuần hoàn các nguyên tố hóa học. Hãy cho biết:
- Cấu tạo nguyên tử của A.
- Tính chất hóa học đặc trưng của A.
- So sánh tính chất hóa học của A với các nguyên tố lân cận.
Hướng dẫn giải:
- A là Na, có 3 lớp electron : 2, 8, 1
- Tính chất hóa học đặc trưng là tính kim loại.
- Tính kim loại của Na mạnh hơn của Mg (12) và Li (3)
- Tính kim loại của Na yếu hơn của K (19)
Bài 5.
a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32gam
oxit sắt này tác dụng hoàn toàn với khí cacbon oxỉt thì thu được 22,4 gam chất rắn.
b) Chất khí sinh ra được hấp thụ hoàn toàn bằng dung dịch tước vôi trong dư. Tính khối lượng kết tủa thu được.
Hướng dẫn giải:
a) Trong 32 g FexOy có 32 - 22,4 = 9,6g oxi
Ta có tỷ số x : y = 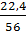 :
: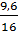 = 0,4 : 0,6 = 2 : 3
Công thức của oxit sắt là Fe2O3
b) Phương trình hóa học
Fe2O3 + 3CO → 3CO2↑ + 2Fe
1mol 3mol 3mol
Số mol Fe2O3 =
= 0,4 : 0,6 = 2 : 3
Công thức của oxit sắt là Fe2O3
b) Phương trình hóa học
Fe2O3 + 3CO → 3CO2↑ + 2Fe
1mol 3mol 3mol
Số mol Fe2O3 = 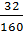 = 0,2 mol suy ra số mol CO2 là 0,6 mol
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,6mol 0,6mol
Khối lượng CaCO3 = 0,6 x 100 = 60 gam.
Bài 6. Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dẫn khí X vào 500ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Hướng dẫn giải:
Số mol MnO2 =
= 0,2 mol suy ra số mol CO2 là 0,6 mol
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,6mol 0,6mol
Khối lượng CaCO3 = 0,6 x 100 = 60 gam.
Bài 6. Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dẫn khí X vào 500ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Hướng dẫn giải:
Số mol MnO2 = 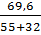 = 0,8 ⇒ Khí X là Cl2
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
0,8mol 0,8mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8mol 1,6mol 0.8mol 0,8mol
Số mol NaOH ban đầu = 4 x 0,5 = 2 mol,
Số mol NaOH dư = 2 - 1,6 = 0,4 mol
= 0,8 ⇒ Khí X là Cl2
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
0,8mol 0,8mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8mol 1,6mol 0.8mol 0,8mol
Số mol NaOH ban đầu = 4 x 0,5 = 2 mol,
Số mol NaOH dư = 2 - 1,6 = 0,4 mol
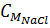 =
=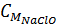 = 0,8:0,5 = 1,6M
= 0,8:0,5 = 1,6M
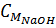 = 0,4 : 0,5 = 0,8M
BÀI TẬP BỔ SUNG
Bài 1. Khi đốt cháy lưu huỳnh, cacbon, photpho trong khí oxi được các oxit axit. Công thức của các axit tương ứng với các oxit axit đó lần lượt là:
a) H2S, H2CO3, H3PO4 b) H2SO3, H2CO3, H3PO4.
c) H2SO4, H2CO3, H3PO4 d) H2SO4, H2SO3, H3PO4.
Hướng dẫn giải: Đáp án b.
Bài 2. Trong hợp chất với hiđro, nguyên tố phi kim X có hóa trị III. Thành phần % khối lượng của hiđro trong hợp chất đó là 17,65%. Xác định X.
Hướng dẫn giải:
XH3
%mH =
= 0,4 : 0,5 = 0,8M
BÀI TẬP BỔ SUNG
Bài 1. Khi đốt cháy lưu huỳnh, cacbon, photpho trong khí oxi được các oxit axit. Công thức của các axit tương ứng với các oxit axit đó lần lượt là:
a) H2S, H2CO3, H3PO4 b) H2SO3, H2CO3, H3PO4.
c) H2SO4, H2CO3, H3PO4 d) H2SO4, H2SO3, H3PO4.
Hướng dẫn giải: Đáp án b.
Bài 2. Trong hợp chất với hiđro, nguyên tố phi kim X có hóa trị III. Thành phần % khối lượng của hiđro trong hợp chất đó là 17,65%. Xác định X.
Hướng dẫn giải:
XH3
%mH = 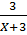 . 100 = 17,65
⇒ X = 14. Vậy X là N.
CTPT của nitơ với hiđro: NH3
Bài 3. Khí X có tỉ khối hơi so với khí hiđro là 17. Đốt 3,4 gam khí X thu lược 2,24 lít SO2 (đktc) và 1.8(g) H2O. Tìm công thức phân tử của khí X.
Hướng dẫn giải:
Mx = 2.17 = 34
nS = 0,1 mol, nH = 0,2 mol. Trong X không chứa oxi. Vậy X là H2S
Bài 4. Đốt hỗn hợp 8.4(g) sắt và 3.2(g) lưu huỳnh trong bình kín đến khi kết thúc phản ứng. Sản phẩm thu được cho phản ứng với dung dịch HCl dư. Tính thể tích khí thoát ra (đktc).
Hướng dẫn giải:
nFe= 8,4:56 = 0,15 mol; nS = 3,2 : 32 = 0,1 mol
Fe + S → FeS (1)
0,1 0,1 0,1 mol
Sản phẩm thu được gồm 0,1 mol FeS, (0,15 - 0,1) = 0,05 mol Fe.
FeS + 2 HCl → FeCl2 + H2S↑ (2)
Fe + 2 HCl → FeCl2 + H2↑ (3)
Từ (2) và (3) ⇒ số mol H2S = 0,1 mol, số mol H2 = 0,05 mol.
Thể tích khí thoát ra (đktc): V = (0,1 + 0,05). 22,4 = 3,36 lit
Bài 5. Đốt cháy hoàn toàn 6,2g P ngoài không khí thu được hợp chất X. Cho X vào bình chứa 286ml H2O thu được dung dịch Y. Tính nồng độ % của dung dịch Y. Biết khối lượng riêng của H2O là 1g/ml.
Hướng dẫn giải:
nP =
. 100 = 17,65
⇒ X = 14. Vậy X là N.
CTPT của nitơ với hiđro: NH3
Bài 3. Khí X có tỉ khối hơi so với khí hiđro là 17. Đốt 3,4 gam khí X thu lược 2,24 lít SO2 (đktc) và 1.8(g) H2O. Tìm công thức phân tử của khí X.
Hướng dẫn giải:
Mx = 2.17 = 34
nS = 0,1 mol, nH = 0,2 mol. Trong X không chứa oxi. Vậy X là H2S
Bài 4. Đốt hỗn hợp 8.4(g) sắt và 3.2(g) lưu huỳnh trong bình kín đến khi kết thúc phản ứng. Sản phẩm thu được cho phản ứng với dung dịch HCl dư. Tính thể tích khí thoát ra (đktc).
Hướng dẫn giải:
nFe= 8,4:56 = 0,15 mol; nS = 3,2 : 32 = 0,1 mol
Fe + S → FeS (1)
0,1 0,1 0,1 mol
Sản phẩm thu được gồm 0,1 mol FeS, (0,15 - 0,1) = 0,05 mol Fe.
FeS + 2 HCl → FeCl2 + H2S↑ (2)
Fe + 2 HCl → FeCl2 + H2↑ (3)
Từ (2) và (3) ⇒ số mol H2S = 0,1 mol, số mol H2 = 0,05 mol.
Thể tích khí thoát ra (đktc): V = (0,1 + 0,05). 22,4 = 3,36 lit
Bài 5. Đốt cháy hoàn toàn 6,2g P ngoài không khí thu được hợp chất X. Cho X vào bình chứa 286ml H2O thu được dung dịch Y. Tính nồng độ % của dung dịch Y. Biết khối lượng riêng của H2O là 1g/ml.
Hướng dẫn giải:
nP = 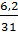 = 0,2 mol
2P + 5O2 → P2O6(X)
0,2 mol ----> 0,1 mol
P2O6 + 3H2O → 2H3PO4 (Y)
0,1 mol ---------> 0,2mol
= 0,2 mol
2P + 5O2 → P2O6(X)
0,2 mol ----> 0,1 mol
P2O6 + 3H2O → 2H3PO4 (Y)
0,1 mol ---------> 0,2mol
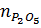 = 0,1 mol ⇒
= 0,1 mol ⇒ 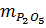 = 142.0,1 = 14,2 gam
= 142.0,1 = 14,2 gam
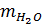 = V . D = 286 . 1 = 286gam.
mdd = 14,2 + 286 = 300,2 gam
mctan =
= V . D = 286 . 1 = 286gam.
mdd = 14,2 + 286 = 300,2 gam
mctan = 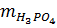 = 98 . 0,2 = 19,6 gam.
C% H3PO4 =
= 98 . 0,2 = 19,6 gam.
C% H3PO4 = 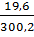 . 100% = 6,53%
Bài 6. Dẫn 2,24 lit CO2 (dktc) vào dung dịch có hoà tan 6,4 gam NaOH thu được dung dịch X gồm 2 muối. Tính khối lượng mỗi muối thu được trong X.
Hướng dẫn giải:
. 100% = 6,53%
Bài 6. Dẫn 2,24 lit CO2 (dktc) vào dung dịch có hoà tan 6,4 gam NaOH thu được dung dịch X gồm 2 muối. Tính khối lượng mỗi muối thu được trong X.
Hướng dẫn giải:
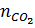 = 2,24 : 22,4 = 0,1 mol
nNaOH = 6,4 : 40 = 0,16 mol.
Phương trình phản ứng: CO2 + NaOH → NaHCO3
CO2 + 2NaOH → Na2CO3 + H2O
y 2y y
Theo phản ứng ta có:
= 2,24 : 22,4 = 0,1 mol
nNaOH = 6,4 : 40 = 0,16 mol.
Phương trình phản ứng: CO2 + NaOH → NaHCO3
CO2 + 2NaOH → Na2CO3 + H2O
y 2y y
Theo phản ứng ta có: 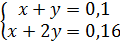 ⇒
⇒ 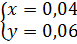
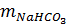 = 0,04. 84 = 3,36g
= 0,04. 84 = 3,36g
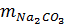 = 0,06.106 = 6,36g
Bài 7. Chọn phương án đúng trong các phương án sau, trong đó tết cả các chất đều tác dụng được với oxi:
a) P, Fe, CH4, CaO b) P, KCl, Fe, CH4
c) CH4, SO2, S, C d) Tất cả các phương án trên
Đáp án đúng: C.
Bài 8. Xác định số phân tử H2 trong 1 ml khí hiđro ở đktc.
Hướng dẫn giải:
Số phân tử H2 =
= 0,06.106 = 6,36g
Bài 7. Chọn phương án đúng trong các phương án sau, trong đó tết cả các chất đều tác dụng được với oxi:
a) P, Fe, CH4, CaO b) P, KCl, Fe, CH4
c) CH4, SO2, S, C d) Tất cả các phương án trên
Đáp án đúng: C.
Bài 8. Xác định số phân tử H2 trong 1 ml khí hiđro ở đktc.
Hướng dẫn giải:
Số phân tử H2 = 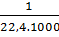 6,02.1023 = 2,69.1019
Bài 9. Một phân tử chứa nguyên tố lưu huỳnh và oxi trong đó mỗi nguyên ô đều chiếm 50% khối lượng. Tỉ lệ số nguyên tử S và O trong phân tử là:
a) 1:1 b) 1: 2 c) 2: 1 d) 1: 3
Hướng dẫn giải: Đáp án: b.
Vì S = 32 và O = 16
Để khối lượng của 2 nguyên tố bằng nhau thì trong phân tử nếu có 1 nguyên tử S thì phải có 2 nguyên tử O.
Bài 10. Người ta phân tích một hỗn hợp gồm khí SO2 và SO3 được 2,4g lưu luỳnh và 2,8g oxi. Tỉ lệ mol SO2 và SO3 trong hỗn hợp là:
a) 1: 1 b) 1:2 c) 1:3 d) 2:1
Hướng dẫn giải: Đáp án: d.
Đặt a, b là số mol SO2 và SO3
Ta có: (a + b). 32 = 2,4
(2a + 3b). 16 = 2,8
Giải hệ phương trình được a = 0,05; b = 0,025
6,02.1023 = 2,69.1019
Bài 9. Một phân tử chứa nguyên tố lưu huỳnh và oxi trong đó mỗi nguyên ô đều chiếm 50% khối lượng. Tỉ lệ số nguyên tử S và O trong phân tử là:
a) 1:1 b) 1: 2 c) 2: 1 d) 1: 3
Hướng dẫn giải: Đáp án: b.
Vì S = 32 và O = 16
Để khối lượng của 2 nguyên tố bằng nhau thì trong phân tử nếu có 1 nguyên tử S thì phải có 2 nguyên tử O.
Bài 10. Người ta phân tích một hỗn hợp gồm khí SO2 và SO3 được 2,4g lưu luỳnh và 2,8g oxi. Tỉ lệ mol SO2 và SO3 trong hỗn hợp là:
a) 1: 1 b) 1:2 c) 1:3 d) 2:1
Hướng dẫn giải: Đáp án: d.
Đặt a, b là số mol SO2 và SO3
Ta có: (a + b). 32 = 2,4
(2a + 3b). 16 = 2,8
Giải hệ phương trình được a = 0,05; b = 0,025
 =
= 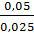 =
=  Bài 11. Một dung dịch H2SO4 có số mol H2SO4 bằng số mol H2O. Xác định nồng độ % của H2SO4 trong dung dịch trên.
Hướng dẫn giải:
Giả sử trong dung dịch H2SO4 có: số mol H2SO4 = số mol H2O = 1mol.
% H2SO4 =
Bài 11. Một dung dịch H2SO4 có số mol H2SO4 bằng số mol H2O. Xác định nồng độ % của H2SO4 trong dung dịch trên.
Hướng dẫn giải:
Giả sử trong dung dịch H2SO4 có: số mol H2SO4 = số mol H2O = 1mol.
% H2SO4 = 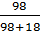 .100% = 84,48%
Bài 12. Hãy chỉ ra trong các chất: SO2, SO3, CuO, CuSO4. Chất nào có hàm lượng oxi nhỏ nhất?
Hướng dẫn giải:
Suy luận: O = 16; S = 32; Cu = 64
Qui Cu sang S (1 nguyên tử Cu thay bằng 2 nguyên tử S). Tính trung bình 1 nguyên tử S kết hợp với bao nhiêu nguyên tử O.
SO2 SO3 CuO CuSO4
1:2 1:3 1:
.100% = 84,48%
Bài 12. Hãy chỉ ra trong các chất: SO2, SO3, CuO, CuSO4. Chất nào có hàm lượng oxi nhỏ nhất?
Hướng dẫn giải:
Suy luận: O = 16; S = 32; Cu = 64
Qui Cu sang S (1 nguyên tử Cu thay bằng 2 nguyên tử S). Tính trung bình 1 nguyên tử S kết hợp với bao nhiêu nguyên tử O.
SO2 SO3 CuO CuSO4
1:2 1:3 1:  1:
1:  So sánh: 3 > 2 >
So sánh: 3 > 2 >  >
>  Kết luận: Chất có hàm lượng oxi nhỏ nhất là CuO.
Bài 13. Tỉ khối của khí A so với khí B là 0,5, tỉ khối của khí B so với khí C là 1,75. Hãy xác định tỉ khối của khí A so với khí C.
Hướng dẫn giải:
Gọi khối lượng mol của các khí A, B, C lần lượt là: A, B, C.
Kết luận: Chất có hàm lượng oxi nhỏ nhất là CuO.
Bài 13. Tỉ khối của khí A so với khí B là 0,5, tỉ khối của khí B so với khí C là 1,75. Hãy xác định tỉ khối của khí A so với khí C.
Hướng dẫn giải:
Gọi khối lượng mol của các khí A, B, C lần lượt là: A, B, C.
 = 0,5 → A = 0,5B ;
= 0,5 → A = 0,5B ;  = 1,75 → C =
= 1,75 → C = 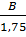
 =
= 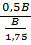 =
=  = 0,875
Bài 14. Đốt hỗn hợp 8.4(g) sắt và 3.2(g) lưu huỳnh trong bình kín đến khi kết thúc phản ứng. Sản phẩm thu được cho phản ứng với dung dịch HCl dư thu được khí nào?
Hướng dẫn giải:
Khí thu được là H2 và H2S.
Fe + S
= 0,875
Bài 14. Đốt hỗn hợp 8.4(g) sắt và 3.2(g) lưu huỳnh trong bình kín đến khi kết thúc phản ứng. Sản phẩm thu được cho phản ứng với dung dịch HCl dư thu được khí nào?
Hướng dẫn giải:
Khí thu được là H2 và H2S.
Fe + S 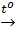 FeS
Theo phương trình: nFe (phản ứng) = nS (phản ứng)
Ta có: nFe > nS ⇒ Hỗn hợp rắn (Fe dư, FeS) + HCl → H2 và H2S
Bài 15. Hãy chọn chất khí ở cột các chất để ghép với cột cách điều chỉnh cho phù hợp.
FeS
Theo phương trình: nFe (phản ứng) = nS (phản ứng)
Ta có: nFe > nS ⇒ Hỗn hợp rắn (Fe dư, FeS) + HCl → H2 và H2S
Bài 15. Hãy chọn chất khí ở cột các chất để ghép với cột cách điều chỉnh cho phù hợp.
| Cách điều chế |
Các chất |
a) Nung CaCO3 đến khoảng 1000°c để diều chế khí …..
b) Cho axit HCl đặc tác dụng với MnO2 để điều chế khí ……
c) Cho Zn tác dụng với axit H2SO4 loãng để điều chế khí ….
d) Nhiệt phân KClO3 với xúc tác là MnO2 để điều chế …… |
1. H2
2. O2
3. Cl2
4. CO2 |
Hướng dẫn giải: a - 4; b - 3; c - 1; d - 2.
Bài 16. Một loại muối sắt clorua chứa 34,46% sắt và 65,54% clo. Xác định công thức phân tử của muối sắt clorua.
Hướng dẫn giải:
Đặt công thức của muối là FexCly
Ta có: x : y = 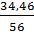 :
: 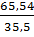 = 1:3
Công thức là FeCl3.
Bài 17. Cần dùng chất nào trong những chất (KMnO4, MnO2, KClO3, PbO2) tác dụng với axit HCl để điều chế khí Cl2 sao cho lượng HCl ít nhất?
Hướng dẫn giải:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O (1)
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O (2)
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O (3)
PbO2 + 4HCl → PbCl2 + Cl2↑ + 2H2O (4)
Để thu được 1mol Cl2 thì số mol HCl cần ở các trường hợp trên là:
ở (1):
= 1:3
Công thức là FeCl3.
Bài 17. Cần dùng chất nào trong những chất (KMnO4, MnO2, KClO3, PbO2) tác dụng với axit HCl để điều chế khí Cl2 sao cho lượng HCl ít nhất?
Hướng dẫn giải:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O (1)
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O (2)
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O (3)
PbO2 + 4HCl → PbCl2 + Cl2↑ + 2H2O (4)
Để thu được 1mol Cl2 thì số mol HCl cần ở các trường hợp trên là:
ở (1): 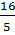 = 3,2
ở (2): 4
ở (3):
= 3,2
ở (2): 4
ở (3):  = 2
ở (4): 4 mol
So sánh: 2 < 3, 2 <4 = 4 Vậy dùng KClO3 thì tiết kiệm đựơc HCl nhất.
Bài 18. Cho kim loại Ca tác dụng với khí clo thu được 22,2(g) muối clorua. Xác định thể tích khí clo đã tham gia phản ứng ở (đktc).
Hướng dẫn giải:
Ca + Cl2 → CaCl2
= 2
ở (4): 4 mol
So sánh: 2 < 3, 2 <4 = 4 Vậy dùng KClO3 thì tiết kiệm đựơc HCl nhất.
Bài 18. Cho kim loại Ca tác dụng với khí clo thu được 22,2(g) muối clorua. Xác định thể tích khí clo đã tham gia phản ứng ở (đktc).
Hướng dẫn giải:
Ca + Cl2 → CaCl2
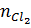 =
= 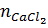 =
= 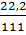 = 0,2mol ⇒
= 0,2mol ⇒ 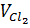 = 0,2 . 22,4 = 4,48 lit.
Bài 19. Hai mẫu kim loại sắt có khối lượng bằng nhau và bằng 2,8g. Một mẫu cho tác dụng với Cl2 và một mẫu cho tác dụng với dung dịch HC1. Xác định khối lượng muối clorua thu được.
Hướng dẫn giải:
nFe =
= 0,2 . 22,4 = 4,48 lit.
Bài 19. Hai mẫu kim loại sắt có khối lượng bằng nhau và bằng 2,8g. Một mẫu cho tác dụng với Cl2 và một mẫu cho tác dụng với dung dịch HC1. Xác định khối lượng muối clorua thu được.
Hướng dẫn giải:
nFe = 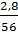 = 0,05(mol)
= 0,05(mol)
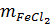 = 127 . 0,05 = 6,35g
= 127 . 0,05 = 6,35g
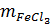 = 162,5 . 0,05 = 8,125
Tổng khối lượng 2 muối: 6,35 +8,125 = 14,475g
Bài 20. Hấp thụ hoàn toàn 0,448 lit khí clo (đktc) vào bởi 50 ml dung dịch NaOH 1M. Tính nồng độ CM của các chất trong dung dịch thu được.
Hướng dẫn giải:
Số mol Cl2:
= 162,5 . 0,05 = 8,125
Tổng khối lượng 2 muối: 6,35 +8,125 = 14,475g
Bài 20. Hấp thụ hoàn toàn 0,448 lit khí clo (đktc) vào bởi 50 ml dung dịch NaOH 1M. Tính nồng độ CM của các chất trong dung dịch thu được.
Hướng dẫn giải:
Số mol Cl2: 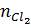 = 0,448 : 22,4 = 0,02 mol
Số mol NaOH : nNaOH = 0,05 .1 = 0,05 mol.
Phương trình phản ứng: Cl2 + 2NaOH → NaCl + NaClO + H2O
0,02 0,04 0,02 0,02
CM(NaCl) = CM(NaClO) = 0,02 : 0,05 = 0,4M
Số mol NaOH dư: n = 0,05 - 0,04 = 0,01 mol
CM(NaOH) = 0.01 : 0,05 = 0,2M
Bài 21. Trong phòng thí nghiệm clo còn được điều chế bằng phương trình phản ứng :
= 0,448 : 22,4 = 0,02 mol
Số mol NaOH : nNaOH = 0,05 .1 = 0,05 mol.
Phương trình phản ứng: Cl2 + 2NaOH → NaCl + NaClO + H2O
0,02 0,04 0,02 0,02
CM(NaCl) = CM(NaClO) = 0,02 : 0,05 = 0,4M
Số mol NaOH dư: n = 0,05 - 0,04 = 0,01 mol
CM(NaOH) = 0.01 : 0,05 = 0,2M
Bài 21. Trong phòng thí nghiệm clo còn được điều chế bằng phương trình phản ứng :
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O.
a) Hãy cân bằng phương trình phản ứng .
b) Tính lượng KMnO4 để điều chế được 11,2 lit Cl2 (đktc).
c) Nếu thay KMnO4 bằng MnO2 thì cần bao nhiêu gam MnO2 để điều chế được lượng Cl2 ở trên.
Hướng dẫn giải:
a) 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
b) 0,2 <--------------- 0,5 mol
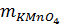 = 0,2.158 = 31,6 gam
c) MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
0,5 <----------- 0,5
= 0,2.158 = 31,6 gam
c) MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
0,5 <----------- 0,5
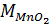 = 0,5 . 87 = 43,5 gam
Bài 22. Nguời ta cho HCl tác dụng với KMnO4 (hoặc MnO2) để điều chế khí clo trong phòng thí nghiệm. Biết phản ứng giữa HCl và KMnO4 diễn ra như sau:
16HCl + 2 KMnO4 → 2KCl + 2MnCl2 + 5Cl2↑ + 8 H2O.
Nếu lấy cùng số mol KMnO4 hoặc MnO2 thì chất nào cho lưọng khí clo nhiều hơn?
Hướng dẫn giải:
Viết 2 phương trình điều chế Cl2 từ MnO2 và KMnO4 với HCl. sau đó so sánh tỉ lệ số mol.
MnO2 + 4 HCl → MnCl2 + Cl2↑ + 2 H2O (1)
a mol -----------------------> a mol
2KMnO4 + 16 HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O (2)
a mol --------------------------------------- >
= 0,5 . 87 = 43,5 gam
Bài 22. Nguời ta cho HCl tác dụng với KMnO4 (hoặc MnO2) để điều chế khí clo trong phòng thí nghiệm. Biết phản ứng giữa HCl và KMnO4 diễn ra như sau:
16HCl + 2 KMnO4 → 2KCl + 2MnCl2 + 5Cl2↑ + 8 H2O.
Nếu lấy cùng số mol KMnO4 hoặc MnO2 thì chất nào cho lưọng khí clo nhiều hơn?
Hướng dẫn giải:
Viết 2 phương trình điều chế Cl2 từ MnO2 và KMnO4 với HCl. sau đó so sánh tỉ lệ số mol.
MnO2 + 4 HCl → MnCl2 + Cl2↑ + 2 H2O (1)
a mol -----------------------> a mol
2KMnO4 + 16 HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O (2)
a mol --------------------------------------- >  amol
So sánh số mol Cl2 thoát ra ở 2 trường hợp trên. Ta có:
amol
So sánh số mol Cl2 thoát ra ở 2 trường hợp trên. Ta có:  a > a
Từ (1) và (2) ⇒ Nếu lấy cùng số mol MnO2 hoặc KMnO4 thì lượng CO tạo thành nhiều hơn nếu dùng KMnO4.
Bài 23. Đun nóng 16,8 gam bột Fe với 6,4gam bột S trong điều kiện không có không khí, thu được chất rắn A. Hoà tan A bằng dung dịch HCl dư thu được khí B. Cho B đi chậm qua dung dịch Pb(NO3)2 tách ra kết tủa D màu đen
a) Tính thể tích khí B (đktc) và khối lượng kết tủa D.
b) Cần bao nhiêu lít O2(đktc) để đốt cháy hoàn toàn khí B.
Hướng dẫn giải:
a) nFe = 16,8 : 56 = 0,3 mol
nS = 6,4 : 32 = 0,2 mol.
Phương trình phản ứng:
Fe + S → FeS
0,2mol 0,2 0,2 mol.
Chất rắn A gồm: 0,2 mol FeS và (0,3 - 0,2) = 0,1 mol Fe dư.
Tác dụng với dung dịch HCl:
FeS + 2HCl → FeCl2 + H2S↑
0,2mol → 0,2 mol
Fe + 2HCl → FeCl2 + H2↑
0,1mol → 0,1 mol
Khí B gồm H2S và H2 dẫn vào dung dịch Pb(NO3)2:
Pb(NO3)2 + H2S → PbS↓ + 2HNO3
0,2 mol 0,2 → 0,2 mol
VB = (0,2 + 0,1). 22,4 = 6,72 (l)
mD = mPbS = 0,2 . 239 = 47,8 gam
b) 2H2S+ 3O2 → 2SO2↑ + 2H2O
0,2 → 0,3mol
2H2 + O2 → 2H2O
0,1→0,05mol
a > a
Từ (1) và (2) ⇒ Nếu lấy cùng số mol MnO2 hoặc KMnO4 thì lượng CO tạo thành nhiều hơn nếu dùng KMnO4.
Bài 23. Đun nóng 16,8 gam bột Fe với 6,4gam bột S trong điều kiện không có không khí, thu được chất rắn A. Hoà tan A bằng dung dịch HCl dư thu được khí B. Cho B đi chậm qua dung dịch Pb(NO3)2 tách ra kết tủa D màu đen
a) Tính thể tích khí B (đktc) và khối lượng kết tủa D.
b) Cần bao nhiêu lít O2(đktc) để đốt cháy hoàn toàn khí B.
Hướng dẫn giải:
a) nFe = 16,8 : 56 = 0,3 mol
nS = 6,4 : 32 = 0,2 mol.
Phương trình phản ứng:
Fe + S → FeS
0,2mol 0,2 0,2 mol.
Chất rắn A gồm: 0,2 mol FeS và (0,3 - 0,2) = 0,1 mol Fe dư.
Tác dụng với dung dịch HCl:
FeS + 2HCl → FeCl2 + H2S↑
0,2mol → 0,2 mol
Fe + 2HCl → FeCl2 + H2↑
0,1mol → 0,1 mol
Khí B gồm H2S và H2 dẫn vào dung dịch Pb(NO3)2:
Pb(NO3)2 + H2S → PbS↓ + 2HNO3
0,2 mol 0,2 → 0,2 mol
VB = (0,2 + 0,1). 22,4 = 6,72 (l)
mD = mPbS = 0,2 . 239 = 47,8 gam
b) 2H2S+ 3O2 → 2SO2↑ + 2H2O
0,2 → 0,3mol
2H2 + O2 → 2H2O
0,1→0,05mol
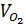 = (0,3 + 0,05) . 22,4 = 7,84 lit.
Bài 24. Cho 8,7 gam MnO2 tác dụng với HCl đặc dư thu được một lượng khí X. Khí X hấp thụ hoàn toàn vào 500ml dung dịch NaOH 0,4M ở nhiệt độ thường thu được dung dịch A. Các chất có trong dung dịch A là:
a) NaOH, NaCl. b) NaOH, NaClO.
c) NaCl, NaClO, NaOH. d) NaCl, NaClO.
Hướng dẫn giải:
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O (1)
Cl2 + 2NaOH → NaCl + NaClO + H2O (2)
Ta có
= (0,3 + 0,05) . 22,4 = 7,84 lit.
Bài 24. Cho 8,7 gam MnO2 tác dụng với HCl đặc dư thu được một lượng khí X. Khí X hấp thụ hoàn toàn vào 500ml dung dịch NaOH 0,4M ở nhiệt độ thường thu được dung dịch A. Các chất có trong dung dịch A là:
a) NaOH, NaCl. b) NaOH, NaClO.
c) NaCl, NaClO, NaOH. d) NaCl, NaClO.
Hướng dẫn giải:
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O (1)
Cl2 + 2NaOH → NaCl + NaClO + H2O (2)
Ta có 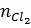 =
= 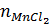 = 8,7 : 87 = 0,1 mol
nNaOH = 0,5 x 0,4 = 0,2 mol = 2
= 8,7 : 87 = 0,1 mol
nNaOH = 0,5 x 0,4 = 0,2 mol = 2 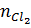 Vậy theo phương trình phản ứng (2) Cl2 phản ứng vừa hết với NaOH, dung dịch A gồm NaCl, NaClO
Vậy theo phương trình phản ứng (2) Cl2 phản ứng vừa hết với NaOH, dung dịch A gồm NaCl, NaClO
(đáp án d).
Bài 25. Một hợp chất tạo bởi 2 nguyên tố là C và O. Biết tỉ lệ về khối lượng của C và O là 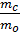 =
=  . Xác định công thức phân tử của hơp chất trên.
Hướng dẫn giải:
Vì C = 12 và O = 16 để được một nguyên tử C trong phân tử thì tỉ số
. Xác định công thức phân tử của hơp chất trên.
Hướng dẫn giải:
Vì C = 12 và O = 16 để được một nguyên tử C trong phân tử thì tỉ số  cần nhân cả tử và mẫu số với 4 được
cần nhân cả tử và mẫu số với 4 được 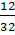 . Suy ra phân tử có 1 nguyên tử C và 2 nguyên tử O. Công thức phân tử của hợp chất là: CO2
Bài 26. Một chất khí có tỉ khối 80 với H2 là 14. Phân tử có 85,7%C về khối lượng còn lại là H. Xác định công thức phân tử của chất khí trên.
Hướng dẫn giải:
Gọi công thức phân tử của chất khí là: CxHy
Khối lượng phân tử CxHy = 2 . 14 = 28.
Số nguyên tử C: x =
. Suy ra phân tử có 1 nguyên tử C và 2 nguyên tử O. Công thức phân tử của hợp chất là: CO2
Bài 26. Một chất khí có tỉ khối 80 với H2 là 14. Phân tử có 85,7%C về khối lượng còn lại là H. Xác định công thức phân tử của chất khí trên.
Hướng dẫn giải:
Gọi công thức phân tử của chất khí là: CxHy
Khối lượng phân tử CxHy = 2 . 14 = 28.
Số nguyên tử C: x = 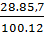 = 2
Số nguyên tử H: y =
= 2
Số nguyên tử H: y = 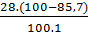 = 4
⇒ Công thức phân tử của chất khí là: C2H4
Bài 27. Cho bột than dư vào hỗn hợp 2 oxit Fe2O3 và CuO đun nóng để phản ứng xảy ra hoàn toàn thu được 2g hỗn hợp kim loại và 2,24 lit khí CO2 duy nhất (đktc). Viết phương trình phản ứng, xác định khối lượng hỗn hợp 2 oxit ban đầu.
Hướng dẫn giải:
2Fe2O3 + 3C → 4Fe + 3CO2↑
2CuO + C → 2Cu + CO2↑
C chiếm oxi của oxit tạo ra CO2 ,
= 4
⇒ Công thức phân tử của chất khí là: C2H4
Bài 27. Cho bột than dư vào hỗn hợp 2 oxit Fe2O3 và CuO đun nóng để phản ứng xảy ra hoàn toàn thu được 2g hỗn hợp kim loại và 2,24 lit khí CO2 duy nhất (đktc). Viết phương trình phản ứng, xác định khối lượng hỗn hợp 2 oxit ban đầu.
Hướng dẫn giải:
2Fe2O3 + 3C → 4Fe + 3CO2↑
2CuO + C → 2Cu + CO2↑
C chiếm oxi của oxit tạo ra CO2 , 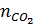 = (2,24 : 22,4) x 0,1 mol
⇒ nO = 2 . 0,1 = 0,2 mol; mO = 16 . 0,2 = 3,2g
nhhoxit = mkim loại + mO = 2 + 3,2 = 5,2 g
Bài 28. Khi luyện quặng sắt thành gang người ta dùng khí co làm chất khử. Khí CO được tạo thành từ 1 tấn than chứa 96% cacbon. Hiệu suất chuyển cacbon thành CO là 80%. Thể tích thu khí CO tạo thành (đktc) là bao nhiêu?.
Hướng dẫn giải:
mc = 1000.103 . 96% = 960.103 gam
Phương trình: 2C + O2 → 2CO
12(g) 28(g)
960.103gam ? gam
mCO = (960.103. 28 : 12) gam .
VCO = (960.103. 28 : 12) : 28 . 22,4 . 80% = 1433,6.103 (l)
Bài 29. Người ta cho hơi nước dư đi qua 12,5 (g) than nóng đỏ chứa 96% cacbon thu được 35,84 (l) hỗn hợp khí CO và H2 (đktc). Tính hiệu suất của phản ứng trên.
Hướng dẫn giải:
mC =12,5 . 96% = 12 gam ⇒ nC =12 : 12 = 1mol
Phương trình: C + H2O
= (2,24 : 22,4) x 0,1 mol
⇒ nO = 2 . 0,1 = 0,2 mol; mO = 16 . 0,2 = 3,2g
nhhoxit = mkim loại + mO = 2 + 3,2 = 5,2 g
Bài 28. Khi luyện quặng sắt thành gang người ta dùng khí co làm chất khử. Khí CO được tạo thành từ 1 tấn than chứa 96% cacbon. Hiệu suất chuyển cacbon thành CO là 80%. Thể tích thu khí CO tạo thành (đktc) là bao nhiêu?.
Hướng dẫn giải:
mc = 1000.103 . 96% = 960.103 gam
Phương trình: 2C + O2 → 2CO
12(g) 28(g)
960.103gam ? gam
mCO = (960.103. 28 : 12) gam .
VCO = (960.103. 28 : 12) : 28 . 22,4 . 80% = 1433,6.103 (l)
Bài 29. Người ta cho hơi nước dư đi qua 12,5 (g) than nóng đỏ chứa 96% cacbon thu được 35,84 (l) hỗn hợp khí CO và H2 (đktc). Tính hiệu suất của phản ứng trên.
Hướng dẫn giải:
mC =12,5 . 96% = 12 gam ⇒ nC =12 : 12 = 1mol
Phương trình: C + H2O 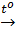 CO + H2
1mol 1mol 1mol
Hiệu suất phản ứng: H =
CO + H2
1mol 1mol 1mol
Hiệu suất phản ứng: H = 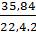 = 80%
Bài 30. Dẫn khí CO2 vào nước cất có pha vài giọt quỳ tím được dung dịch A. Sau đó đun nóng dung dịch A một thời gian. Các hiện tượng xảy ra là:
a) Dung dịch có màu xanh sau đó không màu.
b) Dung dịch có màu đỏ sau đó đổi màu xanh.
c) Dung dịch có màu đỏ sau đó không màu.
d) Dung dịch không màu sau đó xuất hiện màu đỏ.
Hướng dẫn giải: Đáp án c.
H2O + CO2 → H2CO3 (axit cacbonic - quỳ tím hóa đỏ)
Đun nóng CO2 thoát khỏi dung dịch.
Bài 31. Để phân biệt khí CO2 và khí SO2 có thể dùng:
A) Dung dịch Ca(OH)2 B) Dung dịch Br2
C) Dung dịch NaOH D) Dung dịch NaCl
Hướng dẫn giải: Phương án B.
SO2 + Br2 + 2H2O → 2HBr + H2SO4
(màu đỏ) (không màu)
Bài 32. Hỗn hợp A gồm sắt và oxit sắt có khối lượng 5,92gam. Cho khí CO dư đi qua hỗn hợp A nung nóng, sau phản ứng khí thoát ra cho tác dụng với dung dịch Ca(OH)2 dư được 9 gam kết tủa. Xác định khối lượng sắt trong hỗn hợp ban đầu.
Hướng dẫn giải:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,09
= 80%
Bài 30. Dẫn khí CO2 vào nước cất có pha vài giọt quỳ tím được dung dịch A. Sau đó đun nóng dung dịch A một thời gian. Các hiện tượng xảy ra là:
a) Dung dịch có màu xanh sau đó không màu.
b) Dung dịch có màu đỏ sau đó đổi màu xanh.
c) Dung dịch có màu đỏ sau đó không màu.
d) Dung dịch không màu sau đó xuất hiện màu đỏ.
Hướng dẫn giải: Đáp án c.
H2O + CO2 → H2CO3 (axit cacbonic - quỳ tím hóa đỏ)
Đun nóng CO2 thoát khỏi dung dịch.
Bài 31. Để phân biệt khí CO2 và khí SO2 có thể dùng:
A) Dung dịch Ca(OH)2 B) Dung dịch Br2
C) Dung dịch NaOH D) Dung dịch NaCl
Hướng dẫn giải: Phương án B.
SO2 + Br2 + 2H2O → 2HBr + H2SO4
(màu đỏ) (không màu)
Bài 32. Hỗn hợp A gồm sắt và oxit sắt có khối lượng 5,92gam. Cho khí CO dư đi qua hỗn hợp A nung nóng, sau phản ứng khí thoát ra cho tác dụng với dung dịch Ca(OH)2 dư được 9 gam kết tủa. Xác định khối lượng sắt trong hỗn hợp ban đầu.
Hướng dẫn giải:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,09 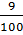 = 0,09
Khi phản ứng CO lấy oxi của sắt oxit thành CO2. (CO + O → CO2)
Ta có số mol CO2 = số mol CO = số mol nguyên tử oxi có trong oxit sắt
mO = 0,09 . 16 = 1,44 (gam)
mFe = 5,92 - 1,44 = 4,48 (gam)
Bài 33. Khi khử hoàn toàn hỗn hợp gồm (FeO, Fe2O3, Fe3O4) bằng khí CO thấy có 4,48 lít CO2 (đktc) thoát ra. Xác định thể tích CO (đktc) đã tham gia phản ứng.
Hướng dẫn giải:
CO lấy O có trong các oxit (FeO, Fe2O3, Fe3O4) tạo ra CO2:
(CO + O → CO2) nCO =
= 0,09
Khi phản ứng CO lấy oxi của sắt oxit thành CO2. (CO + O → CO2)
Ta có số mol CO2 = số mol CO = số mol nguyên tử oxi có trong oxit sắt
mO = 0,09 . 16 = 1,44 (gam)
mFe = 5,92 - 1,44 = 4,48 (gam)
Bài 33. Khi khử hoàn toàn hỗn hợp gồm (FeO, Fe2O3, Fe3O4) bằng khí CO thấy có 4,48 lít CO2 (đktc) thoát ra. Xác định thể tích CO (đktc) đã tham gia phản ứng.
Hướng dẫn giải:
CO lấy O có trong các oxit (FeO, Fe2O3, Fe3O4) tạo ra CO2:
(CO + O → CO2) nCO = 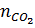 →VCO =
→VCO = 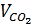 = 4,48 lít
Bài 34. Dẫn 10 lit hỗn hợp khí gồm N2, CO, CO2 (đktc) lần lượt qua ống chứa CuO nung nóng dư, và bình đựng dung dịch Ca(OH)2 dư thấy trong ống xuất hiện 16g Cu và trong bình có 37,5g kết tủa. Tính thể tích khí trong hỗn hợp.
Hướng dẫn giải:
Gọi số mol của CO và CO2 lần lượt là x, y.
Phương trình phản ứng:
CO + CuO
= 4,48 lít
Bài 34. Dẫn 10 lit hỗn hợp khí gồm N2, CO, CO2 (đktc) lần lượt qua ống chứa CuO nung nóng dư, và bình đựng dung dịch Ca(OH)2 dư thấy trong ống xuất hiện 16g Cu và trong bình có 37,5g kết tủa. Tính thể tích khí trong hỗn hợp.
Hướng dẫn giải:
Gọi số mol của CO và CO2 lần lượt là x, y.
Phương trình phản ứng:
CO + CuO 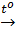 CO2↑ + Cu
x mol x mol x mol
CO2 + Ca(OH)2 → CaCO3↓ + H2O
x + y (x + y) mol
MCu = 64; 64x = 16 ⇒ x = 0,25 mol
Khối lượng CaCO3: = 100.(x + y) = 37,5 ⇒ y = 0,125 mol.
nCO = x = 0,25 mol ⇒
%VCO =
CO2↑ + Cu
x mol x mol x mol
CO2 + Ca(OH)2 → CaCO3↓ + H2O
x + y (x + y) mol
MCu = 64; 64x = 16 ⇒ x = 0,25 mol
Khối lượng CaCO3: = 100.(x + y) = 37,5 ⇒ y = 0,125 mol.
nCO = x = 0,25 mol ⇒
%VCO = 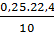 . 100 = 56%
%
. 100 = 56%
%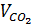 =
= 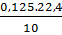 .100 = 28%
% VN2
.100 = 28%
% VN2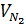 = 100% - (56 + 28)% = 16%.
Bài 35. Dùng khí CO khử hoàn toàn 4 g hỗn hợp CuO và PbO ở nhiệt độ cao. Khí sinh ra sau phản ứng được dẫn vào bình đựng dung dịch Ca(OH)2 dư thu được 10g kết tủa. Viết phương trình phản ứng, tính khối lượng hỗn hợp Cu và Pb thu được.
Hướng dẫn giải:
CuO + CO → Cu + CO2↑ (1)
PbO + CO → Pb + CO2↑ (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O (3)
Từ (1), (2) ta thấy CO lấy oxi của oxit tạo thành CO2: (CO + O → CO2)
nO của oxit = nCO =
= 100% - (56 + 28)% = 16%.
Bài 35. Dùng khí CO khử hoàn toàn 4 g hỗn hợp CuO và PbO ở nhiệt độ cao. Khí sinh ra sau phản ứng được dẫn vào bình đựng dung dịch Ca(OH)2 dư thu được 10g kết tủa. Viết phương trình phản ứng, tính khối lượng hỗn hợp Cu và Pb thu được.
Hướng dẫn giải:
CuO + CO → Cu + CO2↑ (1)
PbO + CO → Pb + CO2↑ (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O (3)
Từ (1), (2) ta thấy CO lấy oxi của oxit tạo thành CO2: (CO + O → CO2)
nO của oxit = nCO = 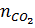 =
= 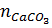 =
= 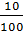 = 0,1
mO = 16 . 0,1 =1,6g; mCu+Pb = 4 - 1,6 = 2,4g
Bài 36. Chỉ dùng thêm H2O và CO2 hãy nhận biết 4 chất rắn đựng trong 4 lọ riêng biệt : NaCl, Na2CO3, CaCO3, BaSO4.
Hướng dẫn giải:
- Hòa vào nước được 2 nhóm chất
+ Tan là: NaCl, Na2CO3 (nhóm 1)
+ Không tan là: CaCO3, BaSO4 (nhóm 2)
- Lấy ít bột 2 chất không tan là CaCO3 và BaSO4 cho vào ống nghiệm chứa nước rồi sục CO2 vào tan được CaCO3 và BaSO4 không tan.
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Lấy dung dịch Ca(HCO3)2 đổ các dung dịch nhóm 1 có kết tủa là dung dịch Na2CO3
Na2CO3 + Ca(HCO3)2 → CaCO3↓ + 2NaHCO3
Bài 37. Khử hoàn toàn 24g hỗn hợp CuO và Fe2O3 có tỉ lệ mol 1 : 1 cần 8,96 lít CO (đktc). Xác định phần trăm khối lượng của CuO và Fe2O3 trong hỗn hợp ban đầu.
Hướng dẫn giải:
Gọi số mol CuO = Fe2O3 = x mol
CuO + CO → Cu + CO2 (1)
x x
Fe2O3 + 3CO → 2Fe (2)
x 3x
từ (1) và (2) suy ra
nCO (1) = nCuO = x =
= 0,1
mO = 16 . 0,1 =1,6g; mCu+Pb = 4 - 1,6 = 2,4g
Bài 36. Chỉ dùng thêm H2O và CO2 hãy nhận biết 4 chất rắn đựng trong 4 lọ riêng biệt : NaCl, Na2CO3, CaCO3, BaSO4.
Hướng dẫn giải:
- Hòa vào nước được 2 nhóm chất
+ Tan là: NaCl, Na2CO3 (nhóm 1)
+ Không tan là: CaCO3, BaSO4 (nhóm 2)
- Lấy ít bột 2 chất không tan là CaCO3 và BaSO4 cho vào ống nghiệm chứa nước rồi sục CO2 vào tan được CaCO3 và BaSO4 không tan.
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Lấy dung dịch Ca(HCO3)2 đổ các dung dịch nhóm 1 có kết tủa là dung dịch Na2CO3
Na2CO3 + Ca(HCO3)2 → CaCO3↓ + 2NaHCO3
Bài 37. Khử hoàn toàn 24g hỗn hợp CuO và Fe2O3 có tỉ lệ mol 1 : 1 cần 8,96 lít CO (đktc). Xác định phần trăm khối lượng của CuO và Fe2O3 trong hỗn hợp ban đầu.
Hướng dẫn giải:
Gọi số mol CuO = Fe2O3 = x mol
CuO + CO → Cu + CO2 (1)
x x
Fe2O3 + 3CO → 2Fe (2)
x 3x
từ (1) và (2) suy ra
nCO (1) = nCuO = x = 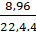 = 0,1 mol
%CuO =
= 0,1 mol
%CuO = 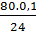 . 100% = 33,33% → % Fe2O3 = (100 - 33,33)% = 67,67%
Bài 38. Cho hỗn hợp khí gồm (CO và CO2) qua dung dịch nước vôi trong dư thấy có 25(g) kết tủa, khí thoát ra khử hoàn toàn vừa đủ với 40(g) CuO ở nhiệt độ cao. Tính thể tích hỗn hợp khí ban đầu ở đktc.
Hướng dẫn giải:
CO2 + Ca(OH)2 → CaCO3 + H2O
CO + CuO
. 100% = 33,33% → % Fe2O3 = (100 - 33,33)% = 67,67%
Bài 38. Cho hỗn hợp khí gồm (CO và CO2) qua dung dịch nước vôi trong dư thấy có 25(g) kết tủa, khí thoát ra khử hoàn toàn vừa đủ với 40(g) CuO ở nhiệt độ cao. Tính thể tích hỗn hợp khí ban đầu ở đktc.
Hướng dẫn giải:
CO2 + Ca(OH)2 → CaCO3 + H2O
CO + CuO 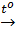 Cu + CO2↑
Cu + CO2↑
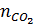 =
= 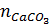 = 25 : 100 = 0,25 mol
nCO = nCuO = 40 : 80 = 0,5 mol
⇒ Thể tích hỗn hợp = (0,25 + 0,5). 22,4 = 16,8 lit
Bài 39. Một hỗn hợp khí có chứa (CO và CO2) người ta sục hỗn hợp khí này vào dung dịch nước vôi trong dư thấy có 25(g) kết tủa và có 2,8(l) khí (đktc) thoát ra. Xác định thể tích hỗn hợp (CO và CO2) ban đầu ở đktc.
Hướng dẫn giải:
CO2 tác dụng với dung dịch nước vôi trong, khí thoát ra là 2,8 (l) CO
CO2 + Ca(OH)2 → CaCO3 + H2O↓
= 25 : 100 = 0,25 mol
nCO = nCuO = 40 : 80 = 0,5 mol
⇒ Thể tích hỗn hợp = (0,25 + 0,5). 22,4 = 16,8 lit
Bài 39. Một hỗn hợp khí có chứa (CO và CO2) người ta sục hỗn hợp khí này vào dung dịch nước vôi trong dư thấy có 25(g) kết tủa và có 2,8(l) khí (đktc) thoát ra. Xác định thể tích hỗn hợp (CO và CO2) ban đầu ở đktc.
Hướng dẫn giải:
CO2 tác dụng với dung dịch nước vôi trong, khí thoát ra là 2,8 (l) CO
CO2 + Ca(OH)2 → CaCO3 + H2O↓
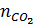 =
= 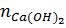 = 0,25mol
⇒ Thể tích hỗn hợp =
= 0,25mol
⇒ Thể tích hỗn hợp = 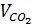 + VCO = 0,25 . 22,4 + 2,8 = 8,4 (l)
Bài 40. Người ta dùng Na2CO3 để loại bỏ các muối Ca(NO3)2, Mg(NO3)2, Ca(HCO3)2, Mg(HCO3)2 có trong nước tự nhiên. Hãy viết các phương trình phản ứng.
Hướng dẫn giải:
Na2CO3 + Ca(NO3)2 → CaCO3↓ + 2NaNO3
Na2CO3 + Mg(NO3)2 → MgCO3↓ + 2NaNO3
Na2CO3 + Ca(HCO3)2 → CaCO3↓ + 2NaHCO3
Na2CO3 + Mg(HCO3)2 → MgCO3↓ + 2NaHCO3
Bài 41. Có 3 dung dịch hỗn hợp (NaHCO3, Na2CO3), (NaHCO3, Na2SO4) và (Na2CO3, Na2SO4). Chỉ dùng thêm cặp dung dịch nào sau đây để nhận biết?
a) Ba(NO3)2 và HNO3 b) KCl và HCl
c) K2SO4 và H2SO4 d) KCl và NaOH
Hướng dẫn giải: Đáp án: a) Ba(NO3)2 và HNO3
Cho Ba(NO3)2 vào từng dung dịch. Lọc tách lấy kết tủa cho tác dụng với HNO3, nước lọc cũng cho tác dụng với HNO3
1) Na2CO3 + Ba(NO3)2 → BaCO3↓ + 2NaNO3
Kết tủa: BaCO3 + 2HNO3 → Ba(NO3)2 + H2O + CO2↑
Nước lọc: NaHCO3 + HNO3 → NaNO3 + H2O + CO2↑
2) Na2SO4 + Ba(NO3)2 → BaSO4↓ + 2NaNO3
Kết tủa: BaSO4 + HNO3 → không tác dụng
Nước lọc: NaHCO3 + HNO3 → CO2↑ + NaNO3 + H2O
3) Na2CO3 + Ba(NO3)2 → BaSO4↓ + 2NaNO3
Na2SO4 + Ba(NO3)2 → BaSO4↓ + 2NaNO3
Kết tủa: (BaCO3 và BaSO4) + HNO3 → Chỉ tan một phần.
Nước lọc: (NaNO3, Ba(NO3)2 dư) + HNO3 → Không tác dụng
Bài 42. Hãy chọn một trong các chất: quỳ tím, phenolphtalein, AgNO3, BaCl2 để nhận biết 4 dung dịch riêng biệt: NaOH, H2SO4, HCl, Na2CO3.
Hướng dẫn giải:
Dùng thuốc thử là: BaCl2
Cho BaCl2 vào 4 dung dịch trên dung dịch có kết tủa là H2SO4 và Na2CO3
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
Lấy một trong các dung dịch còn lại lần lượt tác dụng với 2 kết tủa trên, nếu kết tủa tan là BaCO3 và dung dịch đã lấy là HCl. Kết tủa không tan là BaSO4 và dung dịch đã lấy là NaOH.
Bài 43. Một loại thủy tinh có thành phần như sau: 18,43% K2O; 10,98% CaO; 70,59% SiO2 (theo khối lượng). Xác định công thức hóa học của loại thủy tinh trên.
Hướng dẫn giải:
Đặt công thức của thủy tinh là: X (K2O). y (CaO). z (SiO2)
x : y : z =
+ VCO = 0,25 . 22,4 + 2,8 = 8,4 (l)
Bài 40. Người ta dùng Na2CO3 để loại bỏ các muối Ca(NO3)2, Mg(NO3)2, Ca(HCO3)2, Mg(HCO3)2 có trong nước tự nhiên. Hãy viết các phương trình phản ứng.
Hướng dẫn giải:
Na2CO3 + Ca(NO3)2 → CaCO3↓ + 2NaNO3
Na2CO3 + Mg(NO3)2 → MgCO3↓ + 2NaNO3
Na2CO3 + Ca(HCO3)2 → CaCO3↓ + 2NaHCO3
Na2CO3 + Mg(HCO3)2 → MgCO3↓ + 2NaHCO3
Bài 41. Có 3 dung dịch hỗn hợp (NaHCO3, Na2CO3), (NaHCO3, Na2SO4) và (Na2CO3, Na2SO4). Chỉ dùng thêm cặp dung dịch nào sau đây để nhận biết?
a) Ba(NO3)2 và HNO3 b) KCl và HCl
c) K2SO4 và H2SO4 d) KCl và NaOH
Hướng dẫn giải: Đáp án: a) Ba(NO3)2 và HNO3
Cho Ba(NO3)2 vào từng dung dịch. Lọc tách lấy kết tủa cho tác dụng với HNO3, nước lọc cũng cho tác dụng với HNO3
1) Na2CO3 + Ba(NO3)2 → BaCO3↓ + 2NaNO3
Kết tủa: BaCO3 + 2HNO3 → Ba(NO3)2 + H2O + CO2↑
Nước lọc: NaHCO3 + HNO3 → NaNO3 + H2O + CO2↑
2) Na2SO4 + Ba(NO3)2 → BaSO4↓ + 2NaNO3
Kết tủa: BaSO4 + HNO3 → không tác dụng
Nước lọc: NaHCO3 + HNO3 → CO2↑ + NaNO3 + H2O
3) Na2CO3 + Ba(NO3)2 → BaSO4↓ + 2NaNO3
Na2SO4 + Ba(NO3)2 → BaSO4↓ + 2NaNO3
Kết tủa: (BaCO3 và BaSO4) + HNO3 → Chỉ tan một phần.
Nước lọc: (NaNO3, Ba(NO3)2 dư) + HNO3 → Không tác dụng
Bài 42. Hãy chọn một trong các chất: quỳ tím, phenolphtalein, AgNO3, BaCl2 để nhận biết 4 dung dịch riêng biệt: NaOH, H2SO4, HCl, Na2CO3.
Hướng dẫn giải:
Dùng thuốc thử là: BaCl2
Cho BaCl2 vào 4 dung dịch trên dung dịch có kết tủa là H2SO4 và Na2CO3
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
Lấy một trong các dung dịch còn lại lần lượt tác dụng với 2 kết tủa trên, nếu kết tủa tan là BaCO3 và dung dịch đã lấy là HCl. Kết tủa không tan là BaSO4 và dung dịch đã lấy là NaOH.
Bài 43. Một loại thủy tinh có thành phần như sau: 18,43% K2O; 10,98% CaO; 70,59% SiO2 (theo khối lượng). Xác định công thức hóa học của loại thủy tinh trên.
Hướng dẫn giải:
Đặt công thức của thủy tinh là: X (K2O). y (CaO). z (SiO2)
x : y : z = 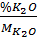 :
: 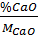 :
: 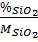 = 1 : 1 : 6
Công thức của thủy tinh là: K2O.CaO.6SiO2.
Bài 44. Trong hợp chất với hiđro nguyên tố R có hóa trị IV trong đó hiđro chiếm 25% về khối lượng. Công thức của hợp chất đó là:
a) PH3 b) CH4 c) SiH4. d) NH3.
Hướng dẫn giải:
Nhận thấy trong các lựa chọn chỉ có cacbon và silic có hóa trị IV trong hợp chất với hiđro: (CH4). Kiểm tra:
= 1 : 1 : 6
Công thức của thủy tinh là: K2O.CaO.6SiO2.
Bài 44. Trong hợp chất với hiđro nguyên tố R có hóa trị IV trong đó hiđro chiếm 25% về khối lượng. Công thức của hợp chất đó là:
a) PH3 b) CH4 c) SiH4. d) NH3.
Hướng dẫn giải:
Nhận thấy trong các lựa chọn chỉ có cacbon và silic có hóa trị IV trong hợp chất với hiđro: (CH4). Kiểm tra: 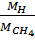 =
= 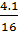 .100% = 25% đúng.
Bài 45. Cho 1,11 gam một kim loại tác dụng với nước, thu được 1,792 lít H2 ở đktc. Xác định tên kim loại kiềm trên.
Hướng dẫn giải:
Gọi kim loại kiềm là M, theo đề bài: Số mol H2 =
.100% = 25% đúng.
Bài 45. Cho 1,11 gam một kim loại tác dụng với nước, thu được 1,792 lít H2 ở đktc. Xác định tên kim loại kiềm trên.
Hướng dẫn giải:
Gọi kim loại kiềm là M, theo đề bài: Số mol H2 = 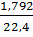 = 0,08
2M + 2H2O → 2MOH + H2↑
0,16 <----------- 0,08 mol
→ M =
= 0,08
2M + 2H2O → 2MOH + H2↑
0,16 <----------- 0,08 mol
→ M = 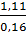 = 6,94 đvC (tra bảng HTTH) ta có kim loại kiềm là: Li
= 6,94 đvC (tra bảng HTTH) ta có kim loại kiềm là: Li
© Bản quyền thuộc về
Bài kiểm tra. Ghi rõ nguồn Bài kiểm tra.com khi sao chép nội dung này.


