Giải bài tập Hóa học 9, Bài 56: Ôn tập cuối năm: Phần I. Hóa học vô cơ
2019-07-05T04:43:11-04:00
2019-07-05T04:43:11-04:00
Giải bài tập Hóa học 9, Bài 56: Ôn tập cuối năm: Phần I. Hóa học vô cơ
/themes/cafe/images/no_image.gif
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Thứ sáu - 05/07/2019 04:43
Giải bài tập Hóa học 9, Bài 56: Ôn tập cuối năm: Phần I. Hóa học vô cơ
Bài 1. Hãy nhận biết từng cặp chất sau đây bằng phương pháp hóa học:
a) Dung dịch H2SO4 và dung dịch CuSO4
b) Dung dịch HCl và dung dịch FeCl2
c) Bột đá vôi CaCO3 và Na2CO3. Viết các phương trình hóa học (nếu có).
Hướng dẫn giải:
a) Dung dịch H2SO4 và dung dịch CuSO4:
- Hai dung dịch này có thể phân biệt bằng mắt thường. Dung dịch CuSO4 có màu xanh, dung dịch H2SO4 đặc không màu, sánh.
- Bằng phương pháp hóa học: Cho hai chất trên vào 2 ống nghiệm đựng sẵn dung dịch NaOH, nếu có kết tủa xanh nhạt thì đó là CuSO4, chất không tạo ra kết tủa là H2SO4
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2 (rắn, xanh nhạt)
b) Dung dịch HCl và dung dịch FeCl2;
Dung dung dịch NaOH để thử, nếu xuất hiện kết tủa, để lâu trong không khí chuyển thành màu nâu đỏ thì đó là dung dịch FeCl2, HCl không có hiện tượng gì.
FeCl2 + 2NaOH → 2NaCl + Fe(OH)2↓
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 (rắn, nâu đỏ)
c) Bột đá vôi CaCO3 và Na2CO3.
Cách 1. Dùng nước để hoà tan, CaCO3 không tan, Na2CO3 tan. Chất không tan và chất tan đều cho tác dụng với HCl đều có bọt khí thoát ra.
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
Cách 2. Cho hai chất trên tác dụng với HCl trước, tạo ra hai dung dịch, thêm dung dịch Na2CO3 vào cả hai dung dịch trên, nếu có kết tủa thì chất ban đầu là CaCO3.Chất không có hiện tượng gì là Na2CO3.
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Bài 2. Có các chất sau: FeCl3, Fe2O3, Fe, Fe(OH)3, FeCl2. Hãy lập thành một dãy biến hóa và viết các phương trình hóa học. Ghi rõ điều kiện phản ứng.
Hướng dẫn giải:
FeCl3 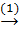 Fe(OH)3
Fe(OH)3 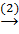 Fe2O3
Fe2O3 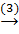 Fe
Fe 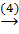 FeCl2
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl (1)
2Fe(OH)3
FeCl2
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl (1)
2Fe(OH)3 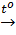 Fe2O3 + 3H2O (2)
Fe2O3 +3CO
Fe2O3 + 3H2O (2)
Fe2O3 +3CO 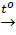 2Fe + 3CO2↑ (3)
Fe + 2HCl → FeCl2 + H2↑ (4)
Bài 3. Có muối ăn và các hóa chất cần thiết. Hãy nêu 2 phương pháp điều chế khí clo. Viết các phương trình hóa học.
Hướng dẫn giải:
Cách 1: Điện phân dung dịch muối ăn bão hoà có màng ngăn.
2NaCl + 2H2O
2Fe + 3CO2↑ (3)
Fe + 2HCl → FeCl2 + H2↑ (4)
Bài 3. Có muối ăn và các hóa chất cần thiết. Hãy nêu 2 phương pháp điều chế khí clo. Viết các phương trình hóa học.
Hướng dẫn giải:
Cách 1: Điện phân dung dịch muối ăn bão hoà có màng ngăn.
2NaCl + 2H2O 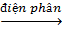 2NaOH + H2↑ + Cl2↑
Cách 2: Điều chế HCl đặc, rồi cho tác dụng với MnO2.
NaCl + H2SO4 → NaHSO4 + HCl
4HCl + MnO2 → MnCl2 + Cl2↑ + 2H2O
Bài 4. Có các bình đựng khí riêng biệt là: CO2, Cl2, CO, H2.
Hãy nhận biết mỗi khí trên bằng phương pháp hóa học. Viết các phương trình hóa học nếu có.
Hướng dẫn giải:
Dung dịch nước vôi trong để nhận ra CO2.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
CO, H2 có thể nhận ra nhờ phản ứng khử bột CuO màu đen thành Cu màu đỏ.
CO + CuO → Cu + CO2↑ nhận ra CO2 nhờ nước vôi trắng.
H2 + CuO → Cu + H2O
Cl2 không có các phản ứng hóa học trên.
Bài 5. Cho 4,8gam hỗn hợp A gồm Fe, Fe2O3 tác dụng với dung dịch CuSO4 dư. Sau khi phản ứng kết thúc, lọc lấy phân chất rắn không tan, rửa sạch bằng nước. Sau đó, cho phần chất rắn tác dụng với dung dịch HCl dư thì còn lại 3,2 gam chất rắn màu đỏ.
a) Viết các phương trình hóa học.
b) Tính thành phần % các chất trong hỗn hợp A ban đầu.
Hướng dẫn giải:
a) Viết các phương trình hóa học
Fe + CuSO4 → Cu + FeSO4 (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
Phần chất rắn màu đỏ không tan là Cu.
b) Tính % về khối lượng các chất trong A.
Theo (1) số mol Fe trong A bằng số mol Cu = 3,2 : 64 = 0,05 mol
%Fe =
2NaOH + H2↑ + Cl2↑
Cách 2: Điều chế HCl đặc, rồi cho tác dụng với MnO2.
NaCl + H2SO4 → NaHSO4 + HCl
4HCl + MnO2 → MnCl2 + Cl2↑ + 2H2O
Bài 4. Có các bình đựng khí riêng biệt là: CO2, Cl2, CO, H2.
Hãy nhận biết mỗi khí trên bằng phương pháp hóa học. Viết các phương trình hóa học nếu có.
Hướng dẫn giải:
Dung dịch nước vôi trong để nhận ra CO2.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
CO, H2 có thể nhận ra nhờ phản ứng khử bột CuO màu đen thành Cu màu đỏ.
CO + CuO → Cu + CO2↑ nhận ra CO2 nhờ nước vôi trắng.
H2 + CuO → Cu + H2O
Cl2 không có các phản ứng hóa học trên.
Bài 5. Cho 4,8gam hỗn hợp A gồm Fe, Fe2O3 tác dụng với dung dịch CuSO4 dư. Sau khi phản ứng kết thúc, lọc lấy phân chất rắn không tan, rửa sạch bằng nước. Sau đó, cho phần chất rắn tác dụng với dung dịch HCl dư thì còn lại 3,2 gam chất rắn màu đỏ.
a) Viết các phương trình hóa học.
b) Tính thành phần % các chất trong hỗn hợp A ban đầu.
Hướng dẫn giải:
a) Viết các phương trình hóa học
Fe + CuSO4 → Cu + FeSO4 (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
Phần chất rắn màu đỏ không tan là Cu.
b) Tính % về khối lượng các chất trong A.
Theo (1) số mol Fe trong A bằng số mol Cu = 3,2 : 64 = 0,05 mol
%Fe = 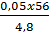 x 100%
x 100% 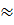 58,3%; % Fe2O3
58,3%; % Fe2O3 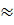 41,7%
41,7%
© Bản quyền thuộc về
Bài kiểm tra. Ghi rõ nguồn Bài kiểm tra.com khi sao chép nội dung này.