I/ Trắc nghiệm khách quan: (5đ)
1/ Dãy nào sau đây gồm các chất đều phản ứng được với dung dịch CuCl2?
A. NaOH, Fe, Mg, Hg
B. Ca(OH)
2, Mg, Ag, AgNO
3
C. NaOH, Fe, Mg, AgNO
3, Ag, Ca(OH)
2
D. NaOH, Fe, Mg, AgNO
3 Ca(OH)
2
2/ Cặp kim loại phản ứng được với nước ở nhiệt độ thường là:
A. Na, Fe B. K, Na
C. Al, Cu D. Mg, K
3/ Dãy kim loại được sắp xếp theo chiều hoạt động hoá học giảm dần là:
A. Na, Al, Fe, Cu, K, Mg
B. Cu, Fe, Al, K, Na, Mg
C. Fe, Al, Cu, Mg, K, Na
D. K, Na, Mg, Al, Fe, Cu
4/ Cho 12,8g kim loại M phản ứng vừa đủ với 4,48 lít khí Cl2 (đktc) tạo ra một muối có công thức là MCl2. Vậy M là kim loại nào?
A. Fe B. Mg C. Zn D. Cu
5/ Những kim loại nào sau đây đều tác dụng được với dung dịch HCl:
A. Mg, Fe, Cu, Zn. B. Ag, Mg, Au, Ba.
C. Al, Fe, Mg, Zn. D. Cu, Mg,, Ca, Zn.
6/ Chọn dãy chất mà tất cả các bazơ đều bị nhiệt phân trong các dãy sau:
A. Fe(OH)
2, Cu(OH)
2 , KOH.
B. Zn(OH)
2 , Fe(OH)
2, Cu(OH)
2.
C. Mg(OH)
2, Cu(OH)
2 ,NaOH.
D. Fe(OH)
2, Ba(OH)
2, Cu(OH)
2.
7/ Một dung dịch Cu(NO3)2 có lẫn AgNO3 người ta có thể dùng kim loại nào sau đây để làm sạch dung dịch Cu(NO3)2
A. Cu ; B. Fe ; C. Al ; D. Au .
8/ Có hỗn hợp khí CO và CO2. Có thể dẫn hỗn hợp khí qua chất nào sau đây để tách được CO ra khỏi hỗn hợp.
A. H
2O B. Ca(OH)
2 C. dd HCl D. dd NaCl .
9/ Ngâm một đinh sắt sạch trong dung dịch CuSO4. Câu trả lời nào sau đây là đúng nhất cho hiện tượng quan sát được
A. Không có hiện tượng nào xảy ra.
B. Không có chất mới nào sinh ra.
C. Kim loại đồng màu đỏ bám ngoài đinh sắt, đinh sắt không có sự thay đổi.
D. Một phần đinh sắt bị hoà tan, kim loại đồng bám ngoài đinh sắt và màu xanh lam của dung dịch ban đầu nhạt dần.
10/. Khí lưu huỳnh dioxit SO2 được tạo thành từ cặp chất nào sau đây:
A. K
2SO
3 và H
2SO
4
B. K
2SO
4 và HCl
C. Na
2SO
3 và NaOH
D. Na
2SO
4 và CuCl
2
II/ Phần Tự Luận: (5đ)
1. Hoàn thành các PTHH theo các sơ đồ sau ( Ghi rõ điều kiện nếu có ) (1,5đ)
Fe (1)→ FeCl
3 (2)→ Fe(OH)
3 (3)→ Fe
2O
3
2. Nêu cách phân biệt các chất lỏng trong các lọ không ghi nhãn sau bằng phương pháp hoá học : HNO
3, H
2SO
4, H
2O. Viết các phương trình hoá học . (1đ)
3. Cho kim loại Na vào dung dịch CuSO
4 có hiện tượng gì xảy ra ? Viết các phương trình phản ứng minh hoạ? (0,5đ)
4. Bài toán : (2,đ)
Cho một lượng bột kẽm (Zn) dư vào 80 ml dung dịch axit Clohidric (HCl) Phản ứng xong, thu được 4,48 lít khí hidro (đktc).
a) Viết phương trình hoá học.
b) Tính khối lượng bột kẽm đã tham gia phản ứng.
c) Tính nồng độ mol/lit của dung dịch HCl đã dùng .
( Biết :Zn = 65; H =1; Cl = 35,5 )
-----------------------------------------------
ĐÁP ÁN VÀ THANG ĐIỂM HOÁ 9 HỌC KỲ 1
I/ Trắc nghiệm khách quan: (5đ)
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| D |
B |
D |
D |
C |
B |
A |
B |
D |
A |
II/ Phần Tự Luận: (5đ)
1. Viết đúng mỗi PTHH :( 0,5đ )
2Fe + 3Cl
3 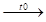
2FeCl
3
FeCl
3 + 3NaOH → Fe(OH)
3 + 3NaCl
2Fe(OH)
3 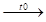
Fe
2O
3 +3H
2O
2. Dùng quỳ tím để nhận ra H
2O không làm đổi màu quỳ tím. (0,25đ)
Dùng dd BaCl
2 để nhận ra H
2SO
4: BaCl
2 + H
2SO
4 → BaSO
4 + 2HCl (0,5đ)
(kết tủa trắng )
Dung dịch còn lại là HNO
3 (0,25đ)
3. Tạo kết tủa màu xanh:
2 Na + 2H
2O → 2NaOH + H
2 (0,25đ)
2NaOH + CuSO
4 → Cu(OH)
2 + Na
2SO
4 (0,25đ)
(kết tủa màu xanh)
4. Bài toán: (2đ)
a. PTHH: Zn + 2HCl → ZnCl
2 + H
2
1mol 2 mol 1mol 1mol
0,2 mol 0,4 mol 0,2 mol 0,2 mol (0,5đ)
- Số mol của 4,48 l khí hidro : n
H2 = V/22,4 = 4,48/22,4= 0,2 (mol) (0,5đ)
b. Khối lượng bột Zn đã tham gia phản ứng : m Zn = n. M = 0,2 . 65 = 13 (g) (0,5đ)
c. Nồng độ M của dd HCl đã dùng :
Đổi : 80 ml = 0,08 lít
C
M = n/V = 0,4/0,08 = 5 (M) (0,5đ)
