Giải bài tập Hóa học 8, Bài 27: Điều chế oxi, phản ứng phân hủy
2019-07-11T00:29:10-04:00
2019-07-11T00:29:10-04:00
Giải bài tập Hóa học 8, Bài 27: Điều chế oxi, phản ứng phân hủy : Hướng dẫn trả lời câu hỏi và bài tập.
/themes/cafe/images/no_image.gif
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Thứ năm - 11/07/2019 00:26
Giải bài tập Hóa học 8, Bài 27: Điều chế oxi, phản ứng phân hủy : Hướng dẫn trả lời câu hỏi và bài tập.
1. Những chất nào trong số các chất sau được dùng để điểu chế oxi trong phòng thí nghiệm?
a) Fe3O4 b) KClO3 c) KMnO4 d) CaCO3
e) Không khí g) H2O.
HƯỚNG DẪN GIẢI:
Những chất dùng để điều chế oxi trong phòng thí nghiệm là: b) KClO3 c) KMnO4.
2. Sự khác nhau về cách điểu chế oxi trong phòng thí nghiệm và trong công nghiệp về nguyên liệu, sản lượng và giá thành?
HƯỚNG DẪN GIẢI:
Sự khác nhau về cách điều chế oxi trong phòng thí nghiệm (PTN) và trong công nghiệp (CN):
- Nguyên liệu: PTN:KClO3 hoặc KMnO4
CN: Không khí và nước
- Sản lượng: PTN:Thể tích nhỏ dùng cho thí nghiệm
CN: Sản lượng lớn dùng cho công nghiệp và y tế
- Giá thành: PTN:Giá thành cao
CN: Giá thành hạ vì nguyên liệu là không khí và nước.
Cách điều chế trong CN và PTN cũng khác nhau, trong PTN nhiệt phân KClO3 (hoặc KMnO4) còn trong CN từ hoá lỏng không khí hay điện phân nước.
3. Sự khác nhau giữa phản ứng phân hủy và phản ứng hoá hợp? Dẫn ra 2 thí dụ để minh họa.
HƯỚNG DẪN GIẢI:
Sự khác nhau giữa phản ứng phân hủy và phản ứng hoá hợp: Phản ứng hoá hợp là phản ứng hoá học trong đó chỉ có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Thí dụ: CaO + CO2 → CaCO3
2Cu + O2 → 2CuO
Phản ứng phân hủy là phản ứng hoá học trong đó một chất sinh ra hai hay nhiều chất mới.
Thí dụ: 2HgO 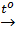 Hg + O2
2KClO3
Hg + O2
2KClO3 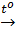 2KCl + 3O2
4. Tính số mol và số gam kali clorat cần thiết để điều chế được:
a) 48g khí oxi; b) 44,8 lít khí oxi (ở đktc).
HƯỚNG DẪN GIẢI:
2KCl + 3O2
4. Tính số mol và số gam kali clorat cần thiết để điều chế được:
a) 48g khí oxi; b) 44,8 lít khí oxi (ở đktc).
HƯỚNG DẪN GIẢI:
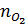 =
= 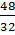 = 1,5mol
Phương trình phản ứng:
2KClO3
= 1,5mol
Phương trình phản ứng:
2KClO3 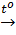 2KCl + 3O2↑
2mol 3mol
xmol 1,5mol
x =
2KCl + 3O2↑
2mol 3mol
xmol 1,5mol
x = 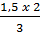 = 1 mol KClO3
= 1 mol KClO3
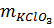 = 122,5 x 1 = 122,5g KClO3
b)
= 122,5 x 1 = 122,5g KClO3
b) 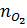 =
= 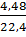 = 2mol
Phương trình phản ứng:
2KClO3
= 2mol
Phương trình phản ứng:
2KClO3 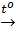 2KCl + 3O2↑
2 mol 3 mol
y mol 2 mol
y =
2KCl + 3O2↑
2 mol 3 mol
y mol 2 mol
y = 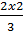 = l,33mol KClO3
= l,33mol KClO3
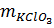 = 1,33 x 122,5 = 162,92g KClO3
5. Nung đá vôi CaCO3 được vôi sống CaO và khí cacbonic CO2.
a) Viết phương trình hoá học của phản ứng.
b) Phản ứng nung vôi thuộc loại phản ứng hoá học nào? Vì sao?
HƯỚNG DẪN GIẢI:
a) Phương trình hoá học của phản ứng:
CaCO3
= 1,33 x 122,5 = 162,92g KClO3
5. Nung đá vôi CaCO3 được vôi sống CaO và khí cacbonic CO2.
a) Viết phương trình hoá học của phản ứng.
b) Phản ứng nung vôi thuộc loại phản ứng hoá học nào? Vì sao?
HƯỚNG DẪN GIẢI:
a) Phương trình hoá học của phản ứng:
CaCO3 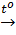 CaO + CO2
b) Phản ứng nung vôi thuộc loại phản ứng phân hủy vì một chất sinh ra hai chất mới.
6. Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng O2 oxi hoá sắt ở nhiệt độ cao.
a) Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxit sắt từ?
b) Tính số gam kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMnO4 thì thu được 1 mol O2.
HƯỚNG DẪN GIẢI:
a) Phương trình hoá học của phản ứng
CaO + CO2
b) Phản ứng nung vôi thuộc loại phản ứng phân hủy vì một chất sinh ra hai chất mới.
6. Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng O2 oxi hoá sắt ở nhiệt độ cao.
a) Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxit sắt từ?
b) Tính số gam kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMnO4 thì thu được 1 mol O2.
HƯỚNG DẪN GIẢI:
a) Phương trình hoá học của phản ứng
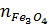 =
= 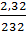 = 0,01mol
3Fe + 2O2 → Fe3O4
3 mol 2 mol 1 mol
x mol y mol 0,01 mol
x = 0,01 x 3 = 0,03 mol Fe → mFe = 0,03 x 56 = l,68g
y = 0,01 x 2 = 0,02 mol O2 →
= 0,01mol
3Fe + 2O2 → Fe3O4
3 mol 2 mol 1 mol
x mol y mol 0,01 mol
x = 0,01 x 3 = 0,03 mol Fe → mFe = 0,03 x 56 = l,68g
y = 0,01 x 2 = 0,02 mol O2 → 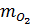 = 0,02 x 32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4
2KMnO4
= 0,02 x 32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4
2KMnO4 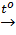 O2 + K2MnO4 + MnO2
2 mol 1 mol
0, 04 mol 0,02 mol
O2 + K2MnO4 + MnO2
2 mol 1 mol
0, 04 mol 0,02 mol
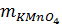 = 0,04 x 158 = 6,32g KMnO4.
= 0,04 x 158 = 6,32g KMnO4.
© Bản quyền thuộc về
Bài kiểm tra. Ghi rõ nguồn Bài kiểm tra.com khi sao chép nội dung này.