Giải bài tập Hóa học 9, Bài 18: Nhôm.
2019-06-30T21:38:04-04:00
2019-06-30T21:38:04-04:00
Giải bài tập Hóa học 9, Bài 18: Nhôm.
/themes/cafe/images/no_image.gif
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Chủ nhật - 30/06/2019 21:38
Giải bài tập Hóa học 9, Bài 18: Nhôm.
Bài 1. Hãy điền vào bảng sau những tính chất tương ứng với những ứng dụng của nhôm.
| |
Tính chất của nhôm |
Ứng dụng của nhôm |
| 1 |
|
Làm dây dẫn điện |
| 2 |
|
Chế tạo máy bay, ôtô, xe lửa... |
| 3 |
|
Làm dụng cụ gia đình: nồi xoong, khung cửa.. |
Hướng dẫn giải:
| |
Tính chất của nhôm |
Ứng dụng của nhôm |
| 1 |
Tính chất dẫn điện tốt, nhẹ hơn đồng |
Làm dây dẫn điện |
| 2 |
Bền và nhẹ |
Chế tạo máy bay, ôtô, xe lửa... |
| 3 |
Tính chất dẫn nhiệt tốt, bền, nhẹ |
Làm dụng cụ gia đình: nồi xoong, khung cửa.. |
Bài 2. Thả một mảnh nhôm vào các ống nghiệm chứa các dung dịch sau:
a) MgSO4; b) CuCl2; c) AgNO3; d) HCl
Cho biết hiện tượng xảy ra. Giải thích và viết phương trình hóa học.
Hướng dẫn giải:
a) Không có hiện tượng gì xảy ra, bởi vì nhôm đứng sau magie.
b) Hiện tượng nhôm tan dần, đồng màu đỏ bám vào mảnh nhôm.
2 Al + 3CuCl2 → 2AlCl3 + 3Cu
c) Hiện tượng nhôm tan dần, bạc bám vào mảnh nhôm.
AI + 3AgNO3 → Al(NO3)3 + 3Ag
d) Hiện tượng nhôm tan dần, có khí hiđro thoát ra.
2Al + 6HCl → 2AlCl3 + 3H2↑
Bài 3. Có nên dùng xô, chậu, nồi nhôm để đựng vôi, nước vôi tôi hoặc vữa xây dựng không? Hãy giải thích.
Hướng dẫn giải:
Không nên dùng xô, chậu, nồi nhôm để đựng vôi, nước vôi tôi hoặc vữa xây dựng, bởi vì nhôm bị phá hủy trong môi trường kiềm. Ban đầu lớp oxit nhôm bị phá hủy theo phương trình hóa học:
Al2O3 + Ca(OH)2 → Ca(AlO2)2 + H2O (1)
Sau đó, nhôm tác dụng với nước:
2Al + 6H2O →2Al(OH)3 + 3H2↑ (2)
Nhôm hiđroxit bị phá hủy trong môi trường kiềm:
2Al(OH)3 + Ca(OH)2 → Ca(AlO2)2 + 4H2O (3)
Các phản ứng (2) và (3) cứ tiếp diễn mãi cho đến khi nhôm bị phá hủy hoàn toàn, do đó không nên dùng xô, chậu, nồi nhôm để đựng vôi, nước vôi tôi hoặc vữa xây dựng.
Bài 4. Có dung dịch muối AlCl3 lẫn tạp chất là CuCl2.Có thể dùng chất nào sau đây để làm sạch muối nhôm? Giải thích và viết phương trình hóa học.
A. AgNO3; B HCl; C. Mg; D. Al; E. Zn
Hướng dẫn giải: Chọn phương án D.
Dùng Al dư đưa vào dung dịch, xảy ra phản ứng hóa học:
2Al + 3CuCl2 → 2AlCl3 + 3Cu
Bài 5. Thành phần hóa học chính của đất sét là: Al2O3.2SiO2.2H2O. Hăy tính phần trăm khối lượng của nhôm trong hợp chất trên.
Hướng dẫn giải:
Khối lượng Al trong một mol đất sét = 2 x 27 = 54(g)
Khối lượng mol đất sét = 54 + 48 + 2(28 + 32) + 2(16 + 2) = 258 (g)
Thành phần % của Al = 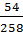 x 100% = 21,1%
Bài 6. Để xác định thành phần phần trăm khối lượng của hỗn hợp A gồm nhôm và magie người ta thực hiện hai thí nghiệm sau:
Thí nghiệm 1: Cho m gam hỗn hợp A tác dụng hết với dung dịch H2SO4 loãng dư, thu được 1568 ml khí ở điều kiện tiêu chuẩn.
Thí nghiệm 2: Cho m gam hỗn hợp A tác dụng với dung dịch NaOH dư, thì phản ứng xong thấy còn lại 0,6gam chất rắn.
Tính phần trăm khối lượng của mỗi chất trong hỗn hợp A.
Hướng dẫn giải:
Các phản ứng hóa học xảy ra trong thí nghiệm 1:
Mg + H2SO4 loãng, dư → MgSO4 + H2↑ (1)
xmol xmol
2Al + 3H2SO4loãng,dư →Al2(SO4)3 + 3H2↑ (2)
ymol 1,5 ymol
Phản ứng hóa học xảy ra trong thí nghiệm 2:
2Al + 2NaOH + 2H2O → 2NaAlO2 +3H2↑
Khối lượng chất rắn còn dư là của Mg = 0,6 gam
x =
x 100% = 21,1%
Bài 6. Để xác định thành phần phần trăm khối lượng của hỗn hợp A gồm nhôm và magie người ta thực hiện hai thí nghiệm sau:
Thí nghiệm 1: Cho m gam hỗn hợp A tác dụng hết với dung dịch H2SO4 loãng dư, thu được 1568 ml khí ở điều kiện tiêu chuẩn.
Thí nghiệm 2: Cho m gam hỗn hợp A tác dụng với dung dịch NaOH dư, thì phản ứng xong thấy còn lại 0,6gam chất rắn.
Tính phần trăm khối lượng của mỗi chất trong hỗn hợp A.
Hướng dẫn giải:
Các phản ứng hóa học xảy ra trong thí nghiệm 1:
Mg + H2SO4 loãng, dư → MgSO4 + H2↑ (1)
xmol xmol
2Al + 3H2SO4loãng,dư →Al2(SO4)3 + 3H2↑ (2)
ymol 1,5 ymol
Phản ứng hóa học xảy ra trong thí nghiệm 2:
2Al + 2NaOH + 2H2O → 2NaAlO2 +3H2↑
Khối lượng chất rắn còn dư là của Mg = 0,6 gam
x = 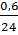 = 0,025 suy ra thể tích H2 ở (1) = 0,025 x 22400 = 560ml
Thể tích H2 do (2) tạo ra = 1568 - 560 = 1008ml
Số mol H2 do (2) tạo ra =
= 0,025 suy ra thể tích H2 ở (1) = 0,025 x 22400 = 560ml
Thể tích H2 do (2) tạo ra = 1568 - 560 = 1008ml
Số mol H2 do (2) tạo ra = 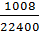 = 0,045 mol
Khối lượng Al =
= 0,045 mol
Khối lượng Al = 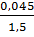 x 27 = 0,81(gam)
Thành phần % theo khối lượng của hỗn hợp A là:
% Mg =
x 27 = 0,81(gam)
Thành phần % theo khối lượng của hỗn hợp A là:
% Mg = 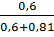 x 100% = 42,55%
%Al = 100 - 42,55 = 57,45%
x 100% = 42,55%
%Al = 100 - 42,55 = 57,45%
© Bản quyền thuộc về
Bài kiểm tra. Ghi rõ nguồn Bài kiểm tra.com khi sao chép nội dung này.