Giải bài tập Hóa học 9, Bài 16:Tính chất hóa học của kim loại.
2019-06-29T06:07:35-04:00
2019-06-29T06:07:35-04:00
Giải bài tập Hóa học 9, Bài 16:Tính chất hóa học của kim loại.
/themes/cafe/images/no_image.gif
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Thứ bảy - 29/06/2019 06:07
Giải bài tập Hóa học 9, Bài 16:Tính chất hóa học của kim loại.
Bài 1. Kim loại có những tính chất hóa học nào? Lấy thí dụ và viết các phương trình hóa học minh họa với kim loại magie. .
Hướng dẫn giải:
Kim loại tác dụng với phi kim
2Mg + O2 → 2MgO
Mg + Cl2 → MgCl2
Kim loại trước H tác dụng với dung dịch axit tạo muối và giải phóng hiđro.
Mg + 2HCl → MgCl2 + H2↑
Kim loại (trừ Na, Ca, K...) tác dụng với dung dịch muối của kim loại hoạt động yếu hơn giải phóng kim loại và tạo ra muối mới.
Mg + CuCl2 → Cu + MgCl2
Bài 2. Hãy hoàn thành phương trình hóa học theo các sơ đổ phản ứng sau đây:
a) ….+ HCl → MgCl2 + H2
b) ….. + AgNO3 → Cu(NO3)2 + Ag
c) …… +…… → ZnO
d …….+ Cl2 → CuCl2
e) ……. + S → K2S.
Hướng dẫn giải:
a) Mg + 2HCl → MgCl2 + H2↑
b) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
c) 2Zn + O2 → 2ZnO
d Cu + Cl2 → CuCl2
e) 2K + S → K2S.
Bài 3: Viết các phương trình phản ứng hóa học xảy ra giữa các cặp chất sau đây:
a) Kẽm + Axit sunfuric loãng;
b) Kẽm + Dung dịch bạc nitrat
c) Natri + Lưu huỳnh;
d) Canxi + Clo.
Hướng dẫn giải:
a) Zn + H2SO4→ ZnSO4 + H2↑
b) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
c) 2Na + S → Na2S
d) Ca + Cl2 → CaCl2
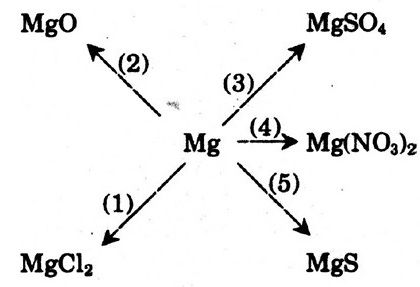
Bài 4: Dựa vào tính chất hóa học của kim loại, hãy viết các phương trình hóa học biểu diễn các chuyển hóa sau đây:
Hướng dẫn giải:
Mg + Cl2 → MgCl2 (11)
2Mg + O2 → 2MgO (2)
Mg + H2SO4 → MgSO4 + H2↑ (3)
Mg + Cu(NO3)2→ Mg(NO3)2 + Cu↓ (4)
Mg + S → MgS (5)
Bài 5: Dự đoán hiện tượng và viết phương trình phản ứng hóa học khi:
a) Đốt dây sắt trong khí clo.
b) Cho một đinh sắt vào ống nghiệm đựng dung dịch CuCl2.
c) Cho một viên kẽm vào dung dịch CuSO4.
Hướng dẫn giải:
a) Đốt dây sắt trong khí clo. Dây sắt cháy sáng trong khí clo, tạo ra khói màu nâu.
2Fe + 3Cl2 → 2FeCl3
b) Cho một đinh sắt vào ống nghiệm đựng dung dịch CuCl2. Màu xanh của dung dịch nhạt dần, đinh sắt phủ một lớp đồng màu đỏ. Fe + CuCl2 → FeCl2 + Cu
c) Cho một viên kẽm vào dung dịch CuSO4. Màu xanh của dung dịch nhạt dần, viên kẽm được bao phủ một lớp đồng màu đỏ. Zn + CuSO4 → ZnSO4 + Cu
Bài 6: Ngâm một lá kẽm trong 20g dung dịch muối đồng sunfat 10% cho đến khi phản ứng kết thúc. Tính khối lượng kẽm đã phản ứng với dung dịch trên và nồng độ phần trăm của dung dịch sau phản ứng.
Hướng dẫn giải:
Zn + CuSO4 → ZnSO4 + Cu
Số mol CuSO4 = 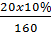 = 0,0125 (mol) = Số mol Zn phản ứng.
mZn = 0,0125 x 65 = 0,8125 (g)
Cứ 1mol Zn phản ứng thì khối lượng dung dịch tăng thêm 1 gam
0,0125mol Zn → 0,0125 gam
= 0,0125 (mol) = Số mol Zn phản ứng.
mZn = 0,0125 x 65 = 0,8125 (g)
Cứ 1mol Zn phản ứng thì khối lượng dung dịch tăng thêm 1 gam
0,0125mol Zn → 0,0125 gam
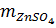 = 0,0125 x 161 = 2,0125 (gam)
= 0,0125 x 161 = 2,0125 (gam)
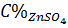 =
= 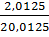 x 100% = 10%
Bài 7: Ngâm một lá đồng trong 20ml dung dịch bạc nitrat cho tới khi đồng không thể tan thêm được nữa. Lấy lá đồng ra, rửa nhọ, làm khô và cân thì thấy khối lượng lá đồng tăng thêm 1,52g. Hãy xác định nồng độ mol của dung dịch bạc nitrat đã dùng (giả thiết toàn bộ lượng bạc giải phóng bám hết vào lá đồng).
Hướng dẫn giải:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
64g Cu tan vào dung dịch thì có 216g Ag bám vào thanh đồng,
1mol 2mol 1mol 2mol m tăng 152g
xmol = 0,02 l,52g
x 100% = 10%
Bài 7: Ngâm một lá đồng trong 20ml dung dịch bạc nitrat cho tới khi đồng không thể tan thêm được nữa. Lấy lá đồng ra, rửa nhọ, làm khô và cân thì thấy khối lượng lá đồng tăng thêm 1,52g. Hãy xác định nồng độ mol của dung dịch bạc nitrat đã dùng (giả thiết toàn bộ lượng bạc giải phóng bám hết vào lá đồng).
Hướng dẫn giải:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
64g Cu tan vào dung dịch thì có 216g Ag bám vào thanh đồng,
1mol 2mol 1mol 2mol m tăng 152g
xmol = 0,02 l,52g
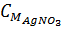 =
= 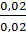 = 1M.
= 1M.
© Bản quyền thuộc về
Bài kiểm tra. Ghi rõ nguồn Bài kiểm tra.com khi sao chép nội dung này.