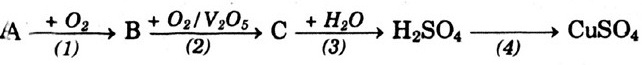Giải bài tập Hóa học 9, Bài 13: Luyện tập chương 1: Các loại hợp chất vô cơ.
2019-06-29T04:56:19-04:00
2019-06-29T04:56:19-04:00
Giải bài tập Hóa học 9, Bài 13: Luyện tập chương 1: Các loại hợp chất vô cơ.
/themes/cafe/images/no_image.gif
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Thứ bảy - 29/06/2019 04:52
Giải bài tập Hóa học 9, Bài 13: Luyện tập chương 1: Các loại hợp chất vô cơ.
Bài 1. Căn cứ vào sơ đồ biểu thị những tính chất hóa học của các hợp chất vô cơ, các em hãy chọn những chất thích hợp để viết các phương trình hóa học cho mỗi hỗn hợp chất.
| 1. Oxit |
2. Bazơ |
| a) Oxit bazơ +... → Bazơ |
a) Bazơ + …→ muối + nước; |
| b) Oxit bazơ +... → muối + nước; |
b) Bazơ +... → muối + nước; |
| c) Oxit axit + ... → axit; |
c) Bazơ +... → muối + bazơ; |
| d) Oxit axit +... → muối + nước; |
d) Bazơ 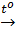 oxit bazơ + nước. oxit bazơ + nước. |
| e) Oxit axit + oxit bazơ → ...…. |
|
| 3. Axit |
4. Muối |
| a) Axit +……→ muối + hiđro; |
a) Muối + …..→ axit + muối; |
| b) Axit +…. → muối +nước; |
b) Muối + ... → muối + bazơ; |
| c) Axit +... → muối + nước; |
c) Muối +... → muối + muối; |
| d) Axit + ….. → muối + axit; |
d) Muối + ….→ muối + kim loại; |
| |
e) Muối 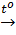 ...... +….. ...... +….. |
Hướng dẫn giải:
Oxit axit tác dụng với nước: CO2 + H2O → H2CO3
Oxit axit tác dụng với dung dịch kiềm: CO2 + 2NaOH → Na2CO3 + H2O
Oxit bazơ tác dụng với dung dịch axit HCl: Na2O + 2HCl → 2NaCl + H2O
Oxit bazơ tác dụng với oxit axit: Na2O + CO2 → Na2CO3
Axit tác dụng với muối: H2SO4 + Ba(NO3)2 → BaSO4↓ + 2HNO3
Axit tác dụng với bazơ: 2KOH + H2SO4 → K2SO4 + 2H2O
Kiềm tác dụng với muối: CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓
Muối tác dụng với muối: MgSO4 + BaCl2 → MgCl2 + BaSO4↓
Muối tác dụng với kim loại: Fe + CuSO4 → Cu + FeSO4
Muối bị nhiệt phân: 2KmnO4 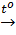 K2MnO4 + MnO2 + O2↑
Bazơ bị nhiệt phân hủy: Cu(OH)2
K2MnO4 + MnO2 + O2↑
Bazơ bị nhiệt phân hủy: Cu(OH)2 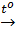 CuO + H2O
Bài 2. Để một mẩu natri hiđroxit trên tấm kính trong không khí, sau vài ngày thấy có chất rắn màu trắng phủ ngoài. Nếu nhỏ vài giọt dung dịch HCl vào chất rắn trắng thấy có khí thoát ra, khí này làm đục nước vôi trong. Chất rắn màu trắng là sản phẩm phản ứng của natri hiđroxit với:
a) Oxi trong không khí.
b) Hơi nước trong không khí.
c) Cacbon đioxit và oxi trong không khí.
d) Cacbon đioxit và hơi nước trong không khí.
e) Cacbon đioxit trong không khí.
Hãy chọn câu đúng. Giải thích và viết phuơng trình hóa học minh họa.
Hướng dẫn giải: phương án C.
O2 + 4Na → 2Na2O.
CO2 + Na2O → Na2CO3.
Bài 3. Trộn một dung dịch có hòa tan 0,2 mol CuCl2 với một dung dịch có hòa tan 20g NaOH. Lọc hỗn hợp các chất sau phản ứng, được kết tủa và nước lọc. Nung kết tủa đến khi khối lượng không đổi.
a) Viết các phương trình hóa học.
b) Tính khối lượng chất rắn thu được sau khi nung.
c) Tính khối lượng các chất có trong nước lọc.
Hướng dẫn giải:
Số mol NaOH =
CuO + H2O
Bài 2. Để một mẩu natri hiđroxit trên tấm kính trong không khí, sau vài ngày thấy có chất rắn màu trắng phủ ngoài. Nếu nhỏ vài giọt dung dịch HCl vào chất rắn trắng thấy có khí thoát ra, khí này làm đục nước vôi trong. Chất rắn màu trắng là sản phẩm phản ứng của natri hiđroxit với:
a) Oxi trong không khí.
b) Hơi nước trong không khí.
c) Cacbon đioxit và oxi trong không khí.
d) Cacbon đioxit và hơi nước trong không khí.
e) Cacbon đioxit trong không khí.
Hãy chọn câu đúng. Giải thích và viết phuơng trình hóa học minh họa.
Hướng dẫn giải: phương án C.
O2 + 4Na → 2Na2O.
CO2 + Na2O → Na2CO3.
Bài 3. Trộn một dung dịch có hòa tan 0,2 mol CuCl2 với một dung dịch có hòa tan 20g NaOH. Lọc hỗn hợp các chất sau phản ứng, được kết tủa và nước lọc. Nung kết tủa đến khi khối lượng không đổi.
a) Viết các phương trình hóa học.
b) Tính khối lượng chất rắn thu được sau khi nung.
c) Tính khối lượng các chất có trong nước lọc.
Hướng dẫn giải:
Số mol NaOH = 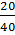 = 0,5 (mol) > 0,4 cho nên NaOH còn dư sau phản ứng.
a) Viết các phương trình hóa học:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
0,2mol 0,4mol 0,2mol 0,4mol
Cu(OH)2
= 0,5 (mol) > 0,4 cho nên NaOH còn dư sau phản ứng.
a) Viết các phương trình hóa học:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
0,2mol 0,4mol 0,2mol 0,4mol
Cu(OH)2 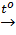 CuO + H2O
0,2mol 0,2mol
b) Tính khối lượng chất rắn thu được sau khi nung.
MCuO = 0,2 x (64 + 16) = 16 (gam)
c) Tính khối lượng các chất có trong nước lọc
mNaOH dư = (0,5 - 0,4)40 = 4 (gam)
mNaCl = 0,4 x 58,5 = 23,4 (gam)
D. BÀI TẬP BỔ SUNG
Bài 1. Cho 20g hỗn hợp hai oxit dạng bột là CuO và Fe2O3. Dùng khí CO để khử hoàn toàn hai oxit thành kim loại thì thu được 14,4 g hỗn hợp hai kim loại.
a) Viết các phương trình hóa học xảy ra.
b) Tính thành phần % theo khối lượng của mỗi oxit trong hỗn hợp.
Hướng dẫn giải:
a) Các phương trình hóa học:
CuO + CO → Cu + CO2↑ (1)
x mol x mol
Fe2O3 + 3CO → 2Fe + 3CO2↑ (2)
y mol 2y mol
b) Tính thành phần % theo khối lượng của mỗi oxit trong hỗn hợp đầu.
Khối lượng hỗn hợp = 80x + 160y = 20 (I)
Khối lượng hai kim loại = 64x + 112y = 14,4 (II)
Giải ra ta được x = 0,05 và y = 0,1.
Khối lượng CuO = 0,05. 80 = 4,0 (g)
Khối lượng Fe2O3 = 0,1 . 160 = 16,0 (g).
Thành phần % của CuO = 4,0 : 20 .100% = 20%
Thành phần % của Fe2O3 = 16,0 : 20 .100% = 80%
Bài 2. Nung 26,8 g hỗn hợp hai muối CaCO3 và MgCO3 thu được 6,72 lít khí CO2 (đktc).
a) Tính khối lượng CaO và MgO thu được.
b) Hấp thụ hoàn toàn lượng khí CO2 ở trên vào 250ml dung dịch NaOH 2M. Cô cạn dung dịch thì thu được những chất nào? Tính khối lượng mỗi chất.
Hướng dẫn giải:
a)
CuO + H2O
0,2mol 0,2mol
b) Tính khối lượng chất rắn thu được sau khi nung.
MCuO = 0,2 x (64 + 16) = 16 (gam)
c) Tính khối lượng các chất có trong nước lọc
mNaOH dư = (0,5 - 0,4)40 = 4 (gam)
mNaCl = 0,4 x 58,5 = 23,4 (gam)
D. BÀI TẬP BỔ SUNG
Bài 1. Cho 20g hỗn hợp hai oxit dạng bột là CuO và Fe2O3. Dùng khí CO để khử hoàn toàn hai oxit thành kim loại thì thu được 14,4 g hỗn hợp hai kim loại.
a) Viết các phương trình hóa học xảy ra.
b) Tính thành phần % theo khối lượng của mỗi oxit trong hỗn hợp.
Hướng dẫn giải:
a) Các phương trình hóa học:
CuO + CO → Cu + CO2↑ (1)
x mol x mol
Fe2O3 + 3CO → 2Fe + 3CO2↑ (2)
y mol 2y mol
b) Tính thành phần % theo khối lượng của mỗi oxit trong hỗn hợp đầu.
Khối lượng hỗn hợp = 80x + 160y = 20 (I)
Khối lượng hai kim loại = 64x + 112y = 14,4 (II)
Giải ra ta được x = 0,05 và y = 0,1.
Khối lượng CuO = 0,05. 80 = 4,0 (g)
Khối lượng Fe2O3 = 0,1 . 160 = 16,0 (g).
Thành phần % của CuO = 4,0 : 20 .100% = 20%
Thành phần % của Fe2O3 = 16,0 : 20 .100% = 80%
Bài 2. Nung 26,8 g hỗn hợp hai muối CaCO3 và MgCO3 thu được 6,72 lít khí CO2 (đktc).
a) Tính khối lượng CaO và MgO thu được.
b) Hấp thụ hoàn toàn lượng khí CO2 ở trên vào 250ml dung dịch NaOH 2M. Cô cạn dung dịch thì thu được những chất nào? Tính khối lượng mỗi chất.
Hướng dẫn giải:
a) 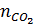 = 6,72 : 22,4 = 0,3(mol)
CaCO3
= 6,72 : 22,4 = 0,3(mol)
CaCO3 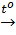 CaO + CO2↑
xmol xmol xmol
MgCO3 → MgO + CO2↑
ymol ymol ymol
Khối lượng của hai muối = 100x + 84y = 26,8 (I)
Số mol của CO2 = x + y = 0,3 (II)
Giải hệ ta được x = 0,1 y = 0,2
mCaO = 0,1 x 56 = 5,6g
mMgO = 0,2 x 40 = 8,0g.
b)
CaO + CO2↑
xmol xmol xmol
MgCO3 → MgO + CO2↑
ymol ymol ymol
Khối lượng của hai muối = 100x + 84y = 26,8 (I)
Số mol của CO2 = x + y = 0,3 (II)
Giải hệ ta được x = 0,1 y = 0,2
mCaO = 0,1 x 56 = 5,6g
mMgO = 0,2 x 40 = 8,0g.
b) 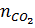 = 0,3 mol
nNaOH = 0,25 x 2 = 0,5 (mol)
Số mol NaOH lớn hơn số mol CO2 nhưng chưa gấp hai lần, cho nên tạo ra hỗn hợp hai muối. Các phương trình hóa học:
CO2 + 2NaOH → Na2CO3 + H2O
a mol 2a mol a mol
CO2 + NaOH → NaHCO3
b mol b mol b mol
Số mol CO2 = a + b = 0,3 (I)
Số mol NaOH = 2a + b = 0,5 (II)
Giải hệ phương trình ta được a = 0,2(mol), b = 0,1(mol)
mNa2CO3 = 0,2 x 106 = 21,2(g);
= 0,3 mol
nNaOH = 0,25 x 2 = 0,5 (mol)
Số mol NaOH lớn hơn số mol CO2 nhưng chưa gấp hai lần, cho nên tạo ra hỗn hợp hai muối. Các phương trình hóa học:
CO2 + 2NaOH → Na2CO3 + H2O
a mol 2a mol a mol
CO2 + NaOH → NaHCO3
b mol b mol b mol
Số mol CO2 = a + b = 0,3 (I)
Số mol NaOH = 2a + b = 0,5 (II)
Giải hệ phương trình ta được a = 0,2(mol), b = 0,1(mol)
mNa2CO3 = 0,2 x 106 = 21,2(g);
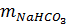 = 0,1 x 84 = 8,4(g)
Bài 3. Cho 1,02 gam oxit nhôm (Al2O3) tác dụng với 100 ra dung dịch axit clohiđric (HCl) 1M.
a) Viết phương trình hóa học.
b) Tính nồng độ mol/l của các chất trong dung dịch sau phản ứng. Coi thể tích dung dịch thay đổi không đáng kể sau phản ứng.
Hướng dẫn giải:
a) Viết phương trình hóa học.
Al2O3 + 6HCl → 2AlCl3 + 3H2O
1mol 6mol 2mol
Số mol Al2O3 là 1,02 : 102 = 0,01 (mol).
Số mol HCl đã phản ứng là 0,06 mol < 0,1 mol tạo thành 0,02 mol AlCl3.
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng.
= 0,1 x 84 = 8,4(g)
Bài 3. Cho 1,02 gam oxit nhôm (Al2O3) tác dụng với 100 ra dung dịch axit clohiđric (HCl) 1M.
a) Viết phương trình hóa học.
b) Tính nồng độ mol/l của các chất trong dung dịch sau phản ứng. Coi thể tích dung dịch thay đổi không đáng kể sau phản ứng.
Hướng dẫn giải:
a) Viết phương trình hóa học.
Al2O3 + 6HCl → 2AlCl3 + 3H2O
1mol 6mol 2mol
Số mol Al2O3 là 1,02 : 102 = 0,01 (mol).
Số mol HCl đã phản ứng là 0,06 mol < 0,1 mol tạo thành 0,02 mol AlCl3.
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng.
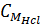 = (0,1 – 0,06) : 0,1 = 0,4M;
= (0,1 – 0,06) : 0,1 = 0,4M;
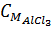 = 0,02 : 0,1 = 0,2M
Bài 4. Hoàn thành các phương trình hóa học biểu diễn dãy biến đổi sau, kèm theo điều kiện (nếu có):
CaCO3
= 0,02 : 0,1 = 0,2M
Bài 4. Hoàn thành các phương trình hóa học biểu diễn dãy biến đổi sau, kèm theo điều kiện (nếu có):
CaCO3 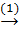 CaO
CaO 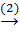 Ca(OH)2
Ca(OH)2  CaCO3
Hướng dẫn giải:
CaCO3
CaCO3
Hướng dẫn giải:
CaCO3 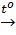 CaO + CO2↑ (1)
CaO + H2O → Ca(OH)2 (2)
Ca(OH)2 + CO2 → CaCO3 + H2O (3)
Bài 5. Hòa tan hoàn toàn 20g hỗn hợp CuO và Fe2O3 vào vừa đủ 500ml dung dịch H2SO4 0,7M.
a) Viết các phương trình hóa học.
b) Tính khối lượng của mỗi oxit trong hỗn hợp ban đầu.
Hướng dẫn giải:
Số mol H2SO4 = 0,51it x 0,7mol/lit = 0,35 mol
Đặt x, y lần lượt là số mol của CuO và Fe2CO3, ta có phương trình về khối lượng hỗn hợp: 80x + 160y = 20 (I)
Các phương trình hóa học:
CuO + H2SO4 →CuSO4 + H2O (1)
x mol x mol
Fe2CO3 + 3H2SO4 → Fe2(SO4)3 + 3H2O (2)
y mol 3y mol
Theo phương trình (1), (2) số mol axit HCl = x + 3y = 0,35 (II)
Kết hợp (I) và (II) ta có: x = 0,05; y = 0,1
mCuO = 80 . 0,05 = 4(g)
mFe2O3 = 160 . 0,1= 16(g)
Bài 6. Cho 0,224 lít khí CO2 (đktc) hấp thụ hoàn toàn vừa đủ vào 500ml dung dịch canxi hiđroxit. Sản phẩm thu được là CaCO3 và H2O.
a) Viết phương trình hóa học.
b) Xác định CM của dung dịch Ca(OH)2 đã dùng.
c) Tính khối lượng CaCO3 thu được.
Hướng dẫn giải:
Số mol CO2 = 0,224l : 22,4l/mol = 0,01 mol
a) Ca(OH)2 + CO2 → CaCO3↓ + H2O
0,01mol 0,01mol 0,01mol
b) Theo phương trình phản ứng, số mol Ca(OH)2 bằng số mol CO2 bằng 0,01 mol.
Nồng độ của Ca(OH)2 CM = 0,01mol: 0,51it = 0,02 M.
c) Khối lượng chất kết tủa thu được: 0,01mol . 100g/mol = 1,00 g.
Bài 7. Cho hỗn hợp khí A gồm CO, CO2 và SO2 có tỷ khối 80 với hiđro là 20,5. Biết số mol của CO2 và SO2 trong hỗn hợp bằng nhau.
a) Tính thành phần % theo thể tích của từng khí trong hỗn hợp.
b) Tính thể tích dung dịch NaOH 1M tối thiểu để chuyển toàn bộ các oxit axit trong 2,24 lít hỗn hợp khí A (đktc) thành muối trung hòa.
Hướng dẫn giải:
Áp dụng phương pháp khối lượng mol trung bình
a) Tính khối lượng moỉ trung bình của hỗn hợp A.
CaO + CO2↑ (1)
CaO + H2O → Ca(OH)2 (2)
Ca(OH)2 + CO2 → CaCO3 + H2O (3)
Bài 5. Hòa tan hoàn toàn 20g hỗn hợp CuO và Fe2O3 vào vừa đủ 500ml dung dịch H2SO4 0,7M.
a) Viết các phương trình hóa học.
b) Tính khối lượng của mỗi oxit trong hỗn hợp ban đầu.
Hướng dẫn giải:
Số mol H2SO4 = 0,51it x 0,7mol/lit = 0,35 mol
Đặt x, y lần lượt là số mol của CuO và Fe2CO3, ta có phương trình về khối lượng hỗn hợp: 80x + 160y = 20 (I)
Các phương trình hóa học:
CuO + H2SO4 →CuSO4 + H2O (1)
x mol x mol
Fe2CO3 + 3H2SO4 → Fe2(SO4)3 + 3H2O (2)
y mol 3y mol
Theo phương trình (1), (2) số mol axit HCl = x + 3y = 0,35 (II)
Kết hợp (I) và (II) ta có: x = 0,05; y = 0,1
mCuO = 80 . 0,05 = 4(g)
mFe2O3 = 160 . 0,1= 16(g)
Bài 6. Cho 0,224 lít khí CO2 (đktc) hấp thụ hoàn toàn vừa đủ vào 500ml dung dịch canxi hiđroxit. Sản phẩm thu được là CaCO3 và H2O.
a) Viết phương trình hóa học.
b) Xác định CM của dung dịch Ca(OH)2 đã dùng.
c) Tính khối lượng CaCO3 thu được.
Hướng dẫn giải:
Số mol CO2 = 0,224l : 22,4l/mol = 0,01 mol
a) Ca(OH)2 + CO2 → CaCO3↓ + H2O
0,01mol 0,01mol 0,01mol
b) Theo phương trình phản ứng, số mol Ca(OH)2 bằng số mol CO2 bằng 0,01 mol.
Nồng độ của Ca(OH)2 CM = 0,01mol: 0,51it = 0,02 M.
c) Khối lượng chất kết tủa thu được: 0,01mol . 100g/mol = 1,00 g.
Bài 7. Cho hỗn hợp khí A gồm CO, CO2 và SO2 có tỷ khối 80 với hiđro là 20,5. Biết số mol của CO2 và SO2 trong hỗn hợp bằng nhau.
a) Tính thành phần % theo thể tích của từng khí trong hỗn hợp.
b) Tính thể tích dung dịch NaOH 1M tối thiểu để chuyển toàn bộ các oxit axit trong 2,24 lít hỗn hợp khí A (đktc) thành muối trung hòa.
Hướng dẫn giải:
Áp dụng phương pháp khối lượng mol trung bình
a) Tính khối lượng moỉ trung bình của hỗn hợp A.
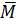 A =
A = 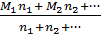 = 20,5 . 2 = 41
Cách giải 1: Số mol CO2 và SO2 là như nhau, do đó khối lượng mol trung bình của hỗn hợp hai khí là:
= 20,5 . 2 = 41
Cách giải 1: Số mol CO2 và SO2 là như nhau, do đó khối lượng mol trung bình của hỗn hợp hai khí là:
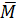 hh =
hh = 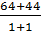 = 54
Nhận xét:
= 54
Nhận xét:  A = (54 + 28) : 2 = 41, hay số mol CO bằng số mol của hai khí còn lại.
Vậy % SO2 = % CO2 = 25% và % CO = 50%.
Cách giải 2: Đặt n1, n2, là số mol của CO và CO2, SO2.
28n1 + 64n2 + 44n2 = 41(n1 + 2n2)
28n1 + 108n2 = 41(n1 + 2n2)
26n2 = 13n1
n1 = 2n2
Vậy % SO2 = % CO2 = 25% và % CO = 50%.
b) Tính thể tích dung dịch NaOH 1M tối thiểu để chuyển toàn bộ các oxit axit thành muối trung hòa.
CO2 + 2NaOH → Na2 CO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O
Tổng số mol NaOH = 2. 2n2 = 2. 0,05 = 0,1 (mol).
Thể tích NaOH 1M tối thiểu cần dùng là 0,1 : 1 = 0,1 (lit)
Bài 8. Dẫn 1,12 lít hỗn hợp khí CO2 và SO2 có tỷ khối so với hiđro là 27 đi qua dung dịch canxi hiđroxit dư.
a) Viết các phương trình hóa học.
b) Tính khối lượng mỗi muối.
c) Tính thành phần % theo thể tích của hỗn hợp khí ban đầu.
Hướng dẫn giải:
nhỗn hợp =
A = (54 + 28) : 2 = 41, hay số mol CO bằng số mol của hai khí còn lại.
Vậy % SO2 = % CO2 = 25% và % CO = 50%.
Cách giải 2: Đặt n1, n2, là số mol của CO và CO2, SO2.
28n1 + 64n2 + 44n2 = 41(n1 + 2n2)
28n1 + 108n2 = 41(n1 + 2n2)
26n2 = 13n1
n1 = 2n2
Vậy % SO2 = % CO2 = 25% và % CO = 50%.
b) Tính thể tích dung dịch NaOH 1M tối thiểu để chuyển toàn bộ các oxit axit thành muối trung hòa.
CO2 + 2NaOH → Na2 CO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O
Tổng số mol NaOH = 2. 2n2 = 2. 0,05 = 0,1 (mol).
Thể tích NaOH 1M tối thiểu cần dùng là 0,1 : 1 = 0,1 (lit)
Bài 8. Dẫn 1,12 lít hỗn hợp khí CO2 và SO2 có tỷ khối so với hiđro là 27 đi qua dung dịch canxi hiđroxit dư.
a) Viết các phương trình hóa học.
b) Tính khối lượng mỗi muối.
c) Tính thành phần % theo thể tích của hỗn hợp khí ban đầu.
Hướng dẫn giải:
nhỗn hợp = 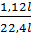 = 0,05(mol);
Khối lượng mol trung bình của hỗn hợp (
= 0,05(mol);
Khối lượng mol trung bình của hỗn hợp ( hh ) = 27 x 2 = 54
a) Phương trình phản ứng:
SO2 + Ca(OH)2 → CaSO3 + H2O
xmol xmol
hh ) = 27 x 2 = 54
a) Phương trình phản ứng:
SO2 + Ca(OH)2 → CaSO3 + H2O
xmol xmol
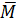 hh =
hh = 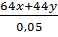 = 54 (I)
CO2 + Ca(OH)2 → CaCO3 + H2O
ymol ymol
x + y = 0,05 (II)
Giải hệ phương trình bậc nhất ta được x = 0,025mol y = 0,025mol
b) Khối lượng các chất sau phản ứng:
= 54 (I)
CO2 + Ca(OH)2 → CaCO3 + H2O
ymol ymol
x + y = 0,05 (II)
Giải hệ phương trình bậc nhất ta được x = 0,025mol y = 0,025mol
b) Khối lượng các chất sau phản ứng:
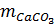 = 0,025 x 100 = 2,5(gam);
= 0,025 x 100 = 2,5(gam);
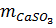 = 0,025 x (40 + 32 + 48) = 3,0 (gam)
c) Thành phần % theo thể tích của hỗn hợp khí ban đầu.
Số mol của CO2 = số mol SO2 = 0,025 mol.
%SO2 = % CO2 = 50%.
Bài 9. Hoàn thành dãy biến đổi hóa học sau, kèm theo điều kiện (nếu có).
MgO
= 0,025 x (40 + 32 + 48) = 3,0 (gam)
c) Thành phần % theo thể tích của hỗn hợp khí ban đầu.
Số mol của CO2 = số mol SO2 = 0,025 mol.
%SO2 = % CO2 = 50%.
Bài 9. Hoàn thành dãy biến đổi hóa học sau, kèm theo điều kiện (nếu có).
MgO 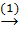 MgCl2
MgCl2  Mg(OH)2
Mg(OH)2 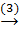 MgSO4
MgSO4 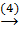 Mg(OH)2
Mg(OH)2 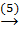 MgO.
Hướng dẫn giải:
MgO + 2HCl → MgCl2 + H2O (1)
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl (2)
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O (3)
MgSO4 + 2NaOH → Mg(OH)2↓ + 2Na2SO4 (4)
Mg(OH)2
MgO.
Hướng dẫn giải:
MgO + 2HCl → MgCl2 + H2O (1)
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl (2)
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O (3)
MgSO4 + 2NaOH → Mg(OH)2↓ + 2Na2SO4 (4)
Mg(OH)2 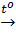 MgO + H2O (5)
Bài 10. Có những chất sau: Na2CO3, CuO, Mg, Al2O3, Fe2O3. Hãy chọn một trong những chất đã cho tác dụng với dung dịch HCl sinh ra:
a) Khí nhẹ hơn không khí và cháy được trong không khí.
b) Dung dịch có màu xanh lam.
c) Dung dịch có màu vàng chanh.
d) Dung dịch không màu.
e) Khí nặng hơn không khí và không duy trì sự cháy.
Hướng dẫn giải:
a) Khí nhẹ hơn không khí và cháy dược trong không khí, đó là hiđro, chọn Mg.
Mg + 2HCl → MgCl2 + H2↑
b) Dung dịch có màu xanh lam là dung dịch muối đồng II, chọn CuO.
CuO +2HCl → CuCl2 + H2O
c) Dung dịch có màu vàng chanh là dung dịch muối sắt III, chọn Fe2O3
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
d) Dung dịch không màu chọn Al2O3
Al2O3 + 6HCl → 2AlCl3 + 3H2O
e) Khí nặng hơn không khí và không duy trì sự cháy, là khí CO2
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
Bài 11. Cho 10,0 g hỗn hợp hai kim loại ở dạng bột là Fe và Cu tác dụng với dung dịch axit HCl dư. Thể tích khí thu được là 2,24 l(đktc).
a) Viết phương trình hóa học.
b) Tính thành phần % theo khối lượng của mỗi kim loại. Biết Fe = 56 đvC.
Hướng dẫn giải:
a) Phương trình hóa học:
Dùng dung dịch axit HCl dư tác dụng với hỗn hợp, chỉ có sắt phản ứng
Fe + 2HCl → FeCl2 + H2
1mol 1mol
0,1mol 0,lmol
Khối lượng Fe = 0,1 . 56 = 5,6 (gam).
Khối lượng Cu là 10,0 - 5,6 = 4,4 (gam).
b) 'Thành phần % của mỗi kim loại:
%Fe = (5,6 : 10,0). 100% = 56%;
%Cu = (4,4 : 10,0). 100% = 44%
Bài 12. Cho 12,0 g hỗn hợp hai kim loại dạng bột là Fe và Cu tác dụng với 200ml dung dịch H2SO4 2M thì thu được 2,24 1 khí hiđro (đktc), dung dịch B và m gam chất không tan.
a) Viết phương trình hóa học.
b) Tính khối lượng mỗi kim loại có trong hỗn hợp và xác định m.
c) Tính nồng độ mol/l của các chất sau phản ứng. Coi thể tích dung dịch thay đổi không đáng kể.
Hướng dẫn giải:
a) Viết phương trình hóa học .
H2SO4 2M là dung dịch loãng, chỉ tác dụng với Fe, không tác dụng với Cu.
H2SO4 + Fe → FeSO4 + H2↑
1mol 1mol 1mol 1mol
b) Tính khối lượng mỗi kim loại có trong hỗn hợp và xác định m.
Số mol H2 = 2,24 : 22,4 = 0,l(mol) = số mol H2SO4 phản ứng là 0,1mol
Số mol Fe = Số mol FeSO4.
mFe = 0,1 . 56 = 5,6 (g); mCu = 12,0 - 5,6 = 6,4 (g).
Phần chất không tan m là khối lượng Cu = 6,4 (g)
c) Tính nồng độ mol/l của các chất sau phản ứng.
Số mol H2SO4 ban đầu là 0,2 . 2 = 0,4 M.
Số mol H2SO4 còn lại là:
0,4 - 0,1 = 0,3 (mol).
CM H2SO4 = 0,3 : 0,2 = 1,5M
CM FeSO4 = 0,1 : 0,2 = 0,5M.
Bài 13. Hoàn thành dãy biến đổi hóa học sau, mỗi mũi tên tương ứng với một phương trình hóa học:
MgO + H2O (5)
Bài 10. Có những chất sau: Na2CO3, CuO, Mg, Al2O3, Fe2O3. Hãy chọn một trong những chất đã cho tác dụng với dung dịch HCl sinh ra:
a) Khí nhẹ hơn không khí và cháy được trong không khí.
b) Dung dịch có màu xanh lam.
c) Dung dịch có màu vàng chanh.
d) Dung dịch không màu.
e) Khí nặng hơn không khí và không duy trì sự cháy.
Hướng dẫn giải:
a) Khí nhẹ hơn không khí và cháy dược trong không khí, đó là hiđro, chọn Mg.
Mg + 2HCl → MgCl2 + H2↑
b) Dung dịch có màu xanh lam là dung dịch muối đồng II, chọn CuO.
CuO +2HCl → CuCl2 + H2O
c) Dung dịch có màu vàng chanh là dung dịch muối sắt III, chọn Fe2O3
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
d) Dung dịch không màu chọn Al2O3
Al2O3 + 6HCl → 2AlCl3 + 3H2O
e) Khí nặng hơn không khí và không duy trì sự cháy, là khí CO2
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
Bài 11. Cho 10,0 g hỗn hợp hai kim loại ở dạng bột là Fe và Cu tác dụng với dung dịch axit HCl dư. Thể tích khí thu được là 2,24 l(đktc).
a) Viết phương trình hóa học.
b) Tính thành phần % theo khối lượng của mỗi kim loại. Biết Fe = 56 đvC.
Hướng dẫn giải:
a) Phương trình hóa học:
Dùng dung dịch axit HCl dư tác dụng với hỗn hợp, chỉ có sắt phản ứng
Fe + 2HCl → FeCl2 + H2
1mol 1mol
0,1mol 0,lmol
Khối lượng Fe = 0,1 . 56 = 5,6 (gam).
Khối lượng Cu là 10,0 - 5,6 = 4,4 (gam).
b) 'Thành phần % của mỗi kim loại:
%Fe = (5,6 : 10,0). 100% = 56%;
%Cu = (4,4 : 10,0). 100% = 44%
Bài 12. Cho 12,0 g hỗn hợp hai kim loại dạng bột là Fe và Cu tác dụng với 200ml dung dịch H2SO4 2M thì thu được 2,24 1 khí hiđro (đktc), dung dịch B và m gam chất không tan.
a) Viết phương trình hóa học.
b) Tính khối lượng mỗi kim loại có trong hỗn hợp và xác định m.
c) Tính nồng độ mol/l của các chất sau phản ứng. Coi thể tích dung dịch thay đổi không đáng kể.
Hướng dẫn giải:
a) Viết phương trình hóa học .
H2SO4 2M là dung dịch loãng, chỉ tác dụng với Fe, không tác dụng với Cu.
H2SO4 + Fe → FeSO4 + H2↑
1mol 1mol 1mol 1mol
b) Tính khối lượng mỗi kim loại có trong hỗn hợp và xác định m.
Số mol H2 = 2,24 : 22,4 = 0,l(mol) = số mol H2SO4 phản ứng là 0,1mol
Số mol Fe = Số mol FeSO4.
mFe = 0,1 . 56 = 5,6 (g); mCu = 12,0 - 5,6 = 6,4 (g).
Phần chất không tan m là khối lượng Cu = 6,4 (g)
c) Tính nồng độ mol/l của các chất sau phản ứng.
Số mol H2SO4 ban đầu là 0,2 . 2 = 0,4 M.
Số mol H2SO4 còn lại là:
0,4 - 0,1 = 0,3 (mol).
CM H2SO4 = 0,3 : 0,2 = 1,5M
CM FeSO4 = 0,1 : 0,2 = 0,5M.
Bài 13. Hoàn thành dãy biến đổi hóa học sau, mỗi mũi tên tương ứng với một phương trình hóa học:
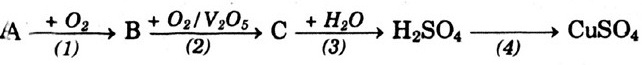 Hướng dẫn giải:
Dùng phương pháp suy luận ngược ta có C là SO3, B là SO2, A có thể là S hoặc FeS2. Theo bài ra ta có các phương trình hóa học sau:
S + O2 → SO2 (1)
Hoặc 4FeS2 + 11O2 → 8SO2↑ + 2Fe2O3
2SO2 + O2
Hướng dẫn giải:
Dùng phương pháp suy luận ngược ta có C là SO3, B là SO2, A có thể là S hoặc FeS2. Theo bài ra ta có các phương trình hóa học sau:
S + O2 → SO2 (1)
Hoặc 4FeS2 + 11O2 → 8SO2↑ + 2Fe2O3
2SO2 + O2 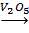 2SO3 (2)
SO3 + H2O → H2SO4 (3)
H2SO4 + CuO → CuSO4 + H2O (4)
Bài 14. Bằng phương pháp hóa học hãy nhận biết các cặp chất sau:
a) Dung dịch HCl và H2SO4.
b) Dung dịch MgCl2 và Na2SO4.
c) Dung dịch MgSO4 và H2SO4
Hướng dẫn giải:
Bằng phương pháp hóa học nhận biết các cặp chất:
a) Dung dịch HCl và dung dịch H2SO4. Dùng thuốc thử BaCl2, nếu chất nào tạo thành kết tủa trắng thì đó là H2SO4.
BaCl2 + H2SO4 → BaSO4↓ + H2O
b) Dung dịch MgCl2 và dung dịch Na2SO4
Cách 1: Dùng thuốc tbử BaCl2 nếu chất nào tạo thành kết tủa trắng thì đó là Na2SO4
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Cách 2: Dùng thuốc thử NaOH, nếu có kết tủa trắng thì đó là MgCl2.
MgCl2 + 2NaOH → Mg (OH)2↓ + 2NaCl
c) Dung dịch MgSO4 và dung dịch H2SO4. Dùng quỳ tím để thử, nếu quỳ tím chuyển sang màu đỏ thì đó là axit H2SO4.
Bài 15. Cho 10,0g hỗn hợp Cu và CuO tác dụng với 200ml dung dịch H2SO4 2M. Sau khi phản ứng kết thúc, lọc, tách riêng phần không tan, cân nặng 6,0g.
a) Viết phương trình hóa học của phản ứng.
b) Tính thành phần % của mỗi chất trong hỗn hợp đầu.
c) Tính nồng độ mol/l của các chất sau phản ứng. Coi thể tích của dung dịch không thay đổi.
Hướng dẫn giải:
a) Dung dịch H2SO4 2M là dung dịch axit loãng. Cu là kim loại đứng sau H trong dãy hoạt động của kim loại nên không phản ứng với H2SO4 loãng.
Chỉ xảy ra phản ứng:
CuO + H2SO4 → CuSO4 + H2O
1mol 1mol 1mol
0,05 0,05 0,05
b) Khối lượng chất rắn không tan là của Cu = 6,0g.
Khối lượng CuO là 4,0g
c) Các chất tan gồm CuSO4 và H2SO4 dư
2SO3 (2)
SO3 + H2O → H2SO4 (3)
H2SO4 + CuO → CuSO4 + H2O (4)
Bài 14. Bằng phương pháp hóa học hãy nhận biết các cặp chất sau:
a) Dung dịch HCl và H2SO4.
b) Dung dịch MgCl2 và Na2SO4.
c) Dung dịch MgSO4 và H2SO4
Hướng dẫn giải:
Bằng phương pháp hóa học nhận biết các cặp chất:
a) Dung dịch HCl và dung dịch H2SO4. Dùng thuốc thử BaCl2, nếu chất nào tạo thành kết tủa trắng thì đó là H2SO4.
BaCl2 + H2SO4 → BaSO4↓ + H2O
b) Dung dịch MgCl2 và dung dịch Na2SO4
Cách 1: Dùng thuốc tbử BaCl2 nếu chất nào tạo thành kết tủa trắng thì đó là Na2SO4
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Cách 2: Dùng thuốc thử NaOH, nếu có kết tủa trắng thì đó là MgCl2.
MgCl2 + 2NaOH → Mg (OH)2↓ + 2NaCl
c) Dung dịch MgSO4 và dung dịch H2SO4. Dùng quỳ tím để thử, nếu quỳ tím chuyển sang màu đỏ thì đó là axit H2SO4.
Bài 15. Cho 10,0g hỗn hợp Cu và CuO tác dụng với 200ml dung dịch H2SO4 2M. Sau khi phản ứng kết thúc, lọc, tách riêng phần không tan, cân nặng 6,0g.
a) Viết phương trình hóa học của phản ứng.
b) Tính thành phần % của mỗi chất trong hỗn hợp đầu.
c) Tính nồng độ mol/l của các chất sau phản ứng. Coi thể tích của dung dịch không thay đổi.
Hướng dẫn giải:
a) Dung dịch H2SO4 2M là dung dịch axit loãng. Cu là kim loại đứng sau H trong dãy hoạt động của kim loại nên không phản ứng với H2SO4 loãng.
Chỉ xảy ra phản ứng:
CuO + H2SO4 → CuSO4 + H2O
1mol 1mol 1mol
0,05 0,05 0,05
b) Khối lượng chất rắn không tan là của Cu = 6,0g.
Khối lượng CuO là 4,0g
c) Các chất tan gồm CuSO4 và H2SO4 dư
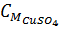 = 0,05 : 0,2 = 0,25M
= 0,05 : 0,2 = 0,25M
 = (0,4 - 0,05): 0,2 = 1,75M
Bài 16. Nêu tính chất hóa học của axit H2SO4 loãng và H2SO4 đặc. Cho các ví dụ minh họa.
Hướng dẫn giải:
a) Dung dịch H2SO4 loãng có những tính chất hóa học của axit.
2KOH + H2SO4 → K2SO4 + 2H2O
Fe + H2SO4 → FeSO4 + H2↑
CuO + H2SO4 → CuSO4 +H2O
b) Dung dịch H2SO4 đặc ngoài những tính chất hóa học của axit còn có những tính chất hóa học riêng.
Cu+ 2H2SO4
= (0,4 - 0,05): 0,2 = 1,75M
Bài 16. Nêu tính chất hóa học của axit H2SO4 loãng và H2SO4 đặc. Cho các ví dụ minh họa.
Hướng dẫn giải:
a) Dung dịch H2SO4 loãng có những tính chất hóa học của axit.
2KOH + H2SO4 → K2SO4 + 2H2O
Fe + H2SO4 → FeSO4 + H2↑
CuO + H2SO4 → CuSO4 +H2O
b) Dung dịch H2SO4 đặc ngoài những tính chất hóa học của axit còn có những tính chất hóa học riêng.
Cu+ 2H2SO4 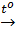 CuSO4 + SO2↑ + 2H2O
C6H12O6
CuSO4 + SO2↑ + 2H2O
C6H12O6 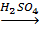 6C + 6H2O
Bài 17. Hòa tan hoàn toàn m gam Fe vừa đủ vào 50ml dung dịch HCl chưa biết nồng độ. Phản ứng kết thúc thu được 3,36 lít khí hiđro (đktc).
a) Viết phương trình hóa học xảy ra.
b) Tính khối lượng Fe đã phản ứng.
c) Tính CM của dung dịch HCl đã dùng.
Hướng dẫn giải:
a) Viết phương trình hóa học
Fe + 2HCl → FeCl2 + H2↑
1mol 2mol 1mol
b) Tính khối lượng Fe đã phản ứng
nFe =
6C + 6H2O
Bài 17. Hòa tan hoàn toàn m gam Fe vừa đủ vào 50ml dung dịch HCl chưa biết nồng độ. Phản ứng kết thúc thu được 3,36 lít khí hiđro (đktc).
a) Viết phương trình hóa học xảy ra.
b) Tính khối lượng Fe đã phản ứng.
c) Tính CM của dung dịch HCl đã dùng.
Hướng dẫn giải:
a) Viết phương trình hóa học
Fe + 2HCl → FeCl2 + H2↑
1mol 2mol 1mol
b) Tính khối lượng Fe đã phản ứng
nFe =  =
= 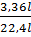 = 0,15(mol) ⇒ Fe = 0,15 x 56 = 8,4 (gam)
c) Tính CM của dung dịch HCl đã dùng:
= 0,15(mol) ⇒ Fe = 0,15 x 56 = 8,4 (gam)
c) Tính CM của dung dịch HCl đã dùng:
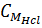 =
= 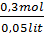 = 6mol/lit = 6M.
Bài 18. Cho 12,1g hỗn hợp CuO và MgO tác dụng vừa đủ với 100ml dung dịch axit HCl 3M.
a) Viết các phương trình hóa học.
b) Tính % theo khối lượng của hỗn hợp.
c) Nếu thay axit HCl bằng dung dịch H2SO4 20% thì khối lượng axit cần dùng là bao nhiêu gam?
Hướng dẫn giải:
a) Viết các phương trình hóa học
CuO + 2HCl → CuCl2 + H2O (1)
ZnO + 2HCl → ZnCl2 + H2O (2)
1mol 2mol
b) Tính % theo khối lượng của mỗi oxit trong hỗn hợp ban đầu.
Đặt x,y là số mol của CuO và ZnO trong hỗn hợp.
Khối lượng hỗn hợp = (64 + 16) x + (65 + 16) y = 12,1(1)
80x + 81y = 12,1
Số mol axit HCl = 2(x + y) = 0,1. 3 = 0,3 (II)
2x + 2y = 0,3
Giải hệ ta được y = 0,1 mol và x = 0,05 mol
Khối lượng CuO = 0,05.80 = 4,0 gam chiếm xấp xỉ 33%
Khối lượng ZnO = 0,1.81 = 8,1 gam chiếm xấp xỉ 67%.
c) Khối lượng axit H2SO4 20% cần dùng
CuO + H2SO4 → CuSO4 + H2O (3)
ZnO + H2SO4 → ZnSO4 + H2O (4)
Số mol H2SO4 (3) = số mol CuO = 0,05 mol
SỐ mol H2SO4 (4) = số mol ZnO = 0,10 mol
Khối lượng H2SO4 = (0,10 + 0,05) 98 = 14,7 (gam)
Khối lượng dung dịch H2SO4 20% cần dùng
= 6mol/lit = 6M.
Bài 18. Cho 12,1g hỗn hợp CuO và MgO tác dụng vừa đủ với 100ml dung dịch axit HCl 3M.
a) Viết các phương trình hóa học.
b) Tính % theo khối lượng của hỗn hợp.
c) Nếu thay axit HCl bằng dung dịch H2SO4 20% thì khối lượng axit cần dùng là bao nhiêu gam?
Hướng dẫn giải:
a) Viết các phương trình hóa học
CuO + 2HCl → CuCl2 + H2O (1)
ZnO + 2HCl → ZnCl2 + H2O (2)
1mol 2mol
b) Tính % theo khối lượng của mỗi oxit trong hỗn hợp ban đầu.
Đặt x,y là số mol của CuO và ZnO trong hỗn hợp.
Khối lượng hỗn hợp = (64 + 16) x + (65 + 16) y = 12,1(1)
80x + 81y = 12,1
Số mol axit HCl = 2(x + y) = 0,1. 3 = 0,3 (II)
2x + 2y = 0,3
Giải hệ ta được y = 0,1 mol và x = 0,05 mol
Khối lượng CuO = 0,05.80 = 4,0 gam chiếm xấp xỉ 33%
Khối lượng ZnO = 0,1.81 = 8,1 gam chiếm xấp xỉ 67%.
c) Khối lượng axit H2SO4 20% cần dùng
CuO + H2SO4 → CuSO4 + H2O (3)
ZnO + H2SO4 → ZnSO4 + H2O (4)
Số mol H2SO4 (3) = số mol CuO = 0,05 mol
SỐ mol H2SO4 (4) = số mol ZnO = 0,10 mol
Khối lượng H2SO4 = (0,10 + 0,05) 98 = 14,7 (gam)
Khối lượng dung dịch H2SO4 20% cần dùng
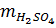 =
= 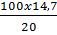 = 73,5(gam)
Bài 19. Trình bày cách phân loại bazơ, nêu các ví dụ minh họa.
Hướng dẫn giải:
Bazơ chia làm hai loại, bazơ tan trong nước thành dung dịch gọi là kiềm và bazơ không tan.
Bazơ kiềm như: NaOH, KOH, Ca(OH)2, Ba(OH)2...
Bazơ không tan như: Fe(OH)2, Fe(OH)3, Cu(OH)2, ...
Bài 20. Cho các bazơ: Cu(OH)2, NaOH, Ba(OH)2, Mg(OH)2, Al(OH)3. Trong số các bazơ trên chất nào có thể
a) Tác dụng với axit HCl. b) Bị nhiệt phân hủy.
c) Tác dụng với CO2. d) Đổi màu quỳ tím thành xanh.
Hướng dẫn giải:
a) Tất cả các bazơ đều tác dụng với axit clohiđric.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
NaOH + HCl → NaCl + H2O
b) Bị nhiệt phân hủy chỉ gồm các bazơ không tan.
Cu(OH)2
= 73,5(gam)
Bài 19. Trình bày cách phân loại bazơ, nêu các ví dụ minh họa.
Hướng dẫn giải:
Bazơ chia làm hai loại, bazơ tan trong nước thành dung dịch gọi là kiềm và bazơ không tan.
Bazơ kiềm như: NaOH, KOH, Ca(OH)2, Ba(OH)2...
Bazơ không tan như: Fe(OH)2, Fe(OH)3, Cu(OH)2, ...
Bài 20. Cho các bazơ: Cu(OH)2, NaOH, Ba(OH)2, Mg(OH)2, Al(OH)3. Trong số các bazơ trên chất nào có thể
a) Tác dụng với axit HCl. b) Bị nhiệt phân hủy.
c) Tác dụng với CO2. d) Đổi màu quỳ tím thành xanh.
Hướng dẫn giải:
a) Tất cả các bazơ đều tác dụng với axit clohiđric.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
NaOH + HCl → NaCl + H2O
b) Bị nhiệt phân hủy chỉ gồm các bazơ không tan.
Cu(OH)2 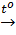 CuO + H2O
Mg(OH)2
CuO + H2O
Mg(OH)2 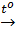 MgO + H2O
2Al(OH)3
MgO + H2O
2Al(OH)3 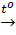 Al2O3 + 3H2O
c) Tác dụng được với CO2 chỉ gồm các kiềm.
Ba(OH)2 + CO2 → BaCO3↓ + H2O
2NaOH + CO2 → Na2CO3 + H2O
Bài 21. Bằng một phương trình hóa học hãy điều chế các bazơ sau:
a) NaOH và Ca(OH)2. b) Cu(OH)2 và Fe(OH)3.
Hướng dẫn giải:
a) Điều chế các dung dịch bazơ
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Nhận xét: Điều chế kiềm từ oxit bazơ tương ứng.
b) Điều chế các bazơ không tan.
CuCl2 + 2NaOH → 2NaCl+ Cu(OH)2↓
FeCl3 + 3NaOH → 3NaCl + Fe(OH)3↓
Nhận xét: Điều chế bazơ không tan từ muối tương ứng tác dụng với kiềm.
Bài 22. Nhận biết các hóa chất đựng trong các lọ không dán nhãn sau bằng phương pháp hóa học: NaCl, Ba(OH)2, NaOH và Na2SO4.
Hướng dẫn giải:
Nhận biết các lọ không nhản: NaCl, Ba(OH)2, NaOH và Na2SO4.
Lấy 4 ống nghiệm, đánh số thứ tự các ống và thử theo các bước sau:
Bước 1: Nhỏ dung dịch của 4 chất trên vào một mẩu quỳ tím. Nếu quỳ hóa xanh thì đó là các kiềm: Ba(OH)2 và NaOH. Nếu quỳ không đổi màu thì đó là NaCl và Na2SO4.
Bước 2. Dùng thuốc thử BaCl2 để phân biệt NaCl và Na2SO4.
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Chất không có hiện tượng gì xảy ra là NaCl.
Bước 3. Dùng dung dịch Na2SO4 để phân biệt Ba(OH)2 và NaOH. Nếu có kết tủa trắng thì đó là Ba(OH)2, chất còn lại là NaOH.
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH
Bài 23. Hòa tan hoàn toàn 15,5 g Na2O vào nước được 500ml dung dịch A.
a) Viết phương trình hóa học và tính nồng độ M của dung dịch A.
b) Tính thể tích dung dịch HCl 20% có d = 1,10 g/ml cần thiết để trung hòa 100ml dung dịch A.
Hướng dẫn giải:
a) Viết phương trình hóa học và tính nồng độ M của dung dịch NaOH.
Na2O + H2O → 2NaOH
Al2O3 + 3H2O
c) Tác dụng được với CO2 chỉ gồm các kiềm.
Ba(OH)2 + CO2 → BaCO3↓ + H2O
2NaOH + CO2 → Na2CO3 + H2O
Bài 21. Bằng một phương trình hóa học hãy điều chế các bazơ sau:
a) NaOH và Ca(OH)2. b) Cu(OH)2 và Fe(OH)3.
Hướng dẫn giải:
a) Điều chế các dung dịch bazơ
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Nhận xét: Điều chế kiềm từ oxit bazơ tương ứng.
b) Điều chế các bazơ không tan.
CuCl2 + 2NaOH → 2NaCl+ Cu(OH)2↓
FeCl3 + 3NaOH → 3NaCl + Fe(OH)3↓
Nhận xét: Điều chế bazơ không tan từ muối tương ứng tác dụng với kiềm.
Bài 22. Nhận biết các hóa chất đựng trong các lọ không dán nhãn sau bằng phương pháp hóa học: NaCl, Ba(OH)2, NaOH và Na2SO4.
Hướng dẫn giải:
Nhận biết các lọ không nhản: NaCl, Ba(OH)2, NaOH và Na2SO4.
Lấy 4 ống nghiệm, đánh số thứ tự các ống và thử theo các bước sau:
Bước 1: Nhỏ dung dịch của 4 chất trên vào một mẩu quỳ tím. Nếu quỳ hóa xanh thì đó là các kiềm: Ba(OH)2 và NaOH. Nếu quỳ không đổi màu thì đó là NaCl và Na2SO4.
Bước 2. Dùng thuốc thử BaCl2 để phân biệt NaCl và Na2SO4.
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Chất không có hiện tượng gì xảy ra là NaCl.
Bước 3. Dùng dung dịch Na2SO4 để phân biệt Ba(OH)2 và NaOH. Nếu có kết tủa trắng thì đó là Ba(OH)2, chất còn lại là NaOH.
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH
Bài 23. Hòa tan hoàn toàn 15,5 g Na2O vào nước được 500ml dung dịch A.
a) Viết phương trình hóa học và tính nồng độ M của dung dịch A.
b) Tính thể tích dung dịch HCl 20% có d = 1,10 g/ml cần thiết để trung hòa 100ml dung dịch A.
Hướng dẫn giải:
a) Viết phương trình hóa học và tính nồng độ M của dung dịch NaOH.
Na2O + H2O → 2NaOH
 = 15,5 : (46 + 16) = 0,25(mol); nNaOH = 2 x 0,25 = 0,5 mol.
= 15,5 : (46 + 16) = 0,25(mol); nNaOH = 2 x 0,25 = 0,5 mol.
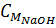 = 0,5 : 0,5 = 1 M.
b) Tính thể tích dung dịch HCl 20% có d = 1,10g/ml cần để trung hòa 100ml dung dịch A.
HCl + NaOH → NaCl + H2O
1mol 1mol
xmol 0,1mol ⇒ x = 0,1 (mol)
Khối lượng HCl là 0,1 . 36,5 = 3,65 (gam).
Khối lượng dung dịch HCl 20% là
= 0,5 : 0,5 = 1 M.
b) Tính thể tích dung dịch HCl 20% có d = 1,10g/ml cần để trung hòa 100ml dung dịch A.
HCl + NaOH → NaCl + H2O
1mol 1mol
xmol 0,1mol ⇒ x = 0,1 (mol)
Khối lượng HCl là 0,1 . 36,5 = 3,65 (gam).
Khối lượng dung dịch HCl 20% là 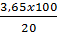 = 18,25 (gam).
Thể tích dung dịch HCl 20% là
= 18,25 (gam).
Thể tích dung dịch HCl 20% là 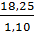 ≈ 16,59 (ml)
Bài 24. Nhận biết các hóa chất đựng trong các lọ không dán nhãn sau bằng phương pháp hóa học: MgCl2, Ba(OH)2, NaOH, Na2CO3, HCl.
Hướng dẫn giải:
Bước 1: Lấy mỗi hóa chất một ít ra một ống nghiệm, thêm 1ml nước cất cho tan hết chất rắn, đánh số thứ tự 1, 2, 3, 4, 5. Lấy hóa chất từ mỗi ống nghiệm bằng ống hút nhỏ giọt, nhỏ lên một mẩu quỳ tím. Nếu quỳ tím chuyển sang màu đỏ thì đó là HCl, nếu quỳ tím chuyển sang màu xanh thì đó là NaOH và Ba(OH)2. Ống nghiệm không có hiện tượng gì xảy ra thì đó là MgCl2 và Na2CO3.
Bước 2: Phân biệt MgCl2 và Na2CO3 bằng dung dịch HCl, nếu thấy có khí thoát ra thì đó là ống nghiệm chứa Na2CO3 chất không có hiệm tượng gì xảy ra là MgCl2.
2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
Bước 3: Phân biệt NaOH và Ba(OH)2 nhờ muối Na2CO3. Nếu Xuất hiện kết tủa trắng thì đó là ống nghiệm chứa Ba(OH)2, nếu không có hiện tượng gì thì đó là NaOH.
Ba(OH)2 + Na2CO3 → BaCO3↓ + 2NaOH
Chất rắn trắng
Bài 25. Điều chế Cu(OH)2 từ các hóa chất CaO, H2O, HCl và CuO. Viết các phương trình hóa học xảy ra.
Hướng dẫn giải:
Cho CuO tác dụng với axit HCl để diều chế muối CuCl2
CuO + 2HCl → CuCl2 + H2O
Cho vôi sống tác dụng với nước:
CaO + H2O → Ca(OH)2
Lọc lấy dung dịch Ca(OH)2, cho tác dụng với dung dịch CuCl2:
CuCl2 + Ca(OH)2 → Cu(OH)2↓ + CaCl2
Bài 26. Cho sơ đồ các phản ứng sau, chọn hóa chất thích hợp điền vào vị trí dấu hỏi và thành lập các phương trình hóa học (kèm theo điều kiện nếu có).
a) Fe(OH)3 → ? + 3H2O
b) ? + NaOH → Na2SO4 + ?
c) ? + Zn(OH)2 → ZnSO4 + 2H2O
d) ? + HCl → NaCl + H2O
e) ? + CO2 → Na2CO3 +H2O
Hướng dẫn giải:
a) Fe(OH)3
≈ 16,59 (ml)
Bài 24. Nhận biết các hóa chất đựng trong các lọ không dán nhãn sau bằng phương pháp hóa học: MgCl2, Ba(OH)2, NaOH, Na2CO3, HCl.
Hướng dẫn giải:
Bước 1: Lấy mỗi hóa chất một ít ra một ống nghiệm, thêm 1ml nước cất cho tan hết chất rắn, đánh số thứ tự 1, 2, 3, 4, 5. Lấy hóa chất từ mỗi ống nghiệm bằng ống hút nhỏ giọt, nhỏ lên một mẩu quỳ tím. Nếu quỳ tím chuyển sang màu đỏ thì đó là HCl, nếu quỳ tím chuyển sang màu xanh thì đó là NaOH và Ba(OH)2. Ống nghiệm không có hiện tượng gì xảy ra thì đó là MgCl2 và Na2CO3.
Bước 2: Phân biệt MgCl2 và Na2CO3 bằng dung dịch HCl, nếu thấy có khí thoát ra thì đó là ống nghiệm chứa Na2CO3 chất không có hiệm tượng gì xảy ra là MgCl2.
2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
Bước 3: Phân biệt NaOH và Ba(OH)2 nhờ muối Na2CO3. Nếu Xuất hiện kết tủa trắng thì đó là ống nghiệm chứa Ba(OH)2, nếu không có hiện tượng gì thì đó là NaOH.
Ba(OH)2 + Na2CO3 → BaCO3↓ + 2NaOH
Chất rắn trắng
Bài 25. Điều chế Cu(OH)2 từ các hóa chất CaO, H2O, HCl và CuO. Viết các phương trình hóa học xảy ra.
Hướng dẫn giải:
Cho CuO tác dụng với axit HCl để diều chế muối CuCl2
CuO + 2HCl → CuCl2 + H2O
Cho vôi sống tác dụng với nước:
CaO + H2O → Ca(OH)2
Lọc lấy dung dịch Ca(OH)2, cho tác dụng với dung dịch CuCl2:
CuCl2 + Ca(OH)2 → Cu(OH)2↓ + CaCl2
Bài 26. Cho sơ đồ các phản ứng sau, chọn hóa chất thích hợp điền vào vị trí dấu hỏi và thành lập các phương trình hóa học (kèm theo điều kiện nếu có).
a) Fe(OH)3 → ? + 3H2O
b) ? + NaOH → Na2SO4 + ?
c) ? + Zn(OH)2 → ZnSO4 + 2H2O
d) ? + HCl → NaCl + H2O
e) ? + CO2 → Na2CO3 +H2O
Hướng dẫn giải:
a) Fe(OH)3  Fe2O3 + 3H2O
b) CuSO4 + NaOH → Na2SO4 + Cu(OH)2↓
c) H2SO4 + Zn(OH)2 → ZnSO4 + 2H2O
d) NaOH + HCl → NaCl + H2O
e) 2NaOH + CO2 → Na2CO3 +H2O
Bài 27. Dẫn từ từ 1,12 lít khí CO2 vào 100ml dung dịch Ba(OH)2 2M.
a) Tính khối lượng muối thu được sau phản ứng.
b) Nồng độ CM của Ba(OH)2 sau phản ứng, coi thể tích dung dịch không thay đổi.
Hướng dẫn giải:
a) Số mol CO2 = 1,12 : 22,4 = 0,05(mol).
Số mol Ba(OH)2 = 0,101it. 2mol/lit = 0,20mol.
So sánh số mol của hai chất thấy rằng Ba(OH)2 dư, do đó chỉ tạo ra BaCO3
Ba(OH)2 + CO2 → BaCO3↓ + H2O
0,05mol 0,05mol 0,05mol
Khối lượng muấi thu được sau phản ứng là:
0,05 x 197 = 9,85 (gam).
b) Chất dư là Ba(OH)2
Sô mol Ba(OH)2 dư là: 0,20 - 0,05 = 0,15 (mol)
Nồng độ Ba(OH)2 dư là: 0,15 : 0,1 = 1,50M
Bài 28. Hoàn thành dãy biến hóa hóa học sau, kèm theo điều kiện, nếu có.
Fe2O3 + 3H2O
b) CuSO4 + NaOH → Na2SO4 + Cu(OH)2↓
c) H2SO4 + Zn(OH)2 → ZnSO4 + 2H2O
d) NaOH + HCl → NaCl + H2O
e) 2NaOH + CO2 → Na2CO3 +H2O
Bài 27. Dẫn từ từ 1,12 lít khí CO2 vào 100ml dung dịch Ba(OH)2 2M.
a) Tính khối lượng muối thu được sau phản ứng.
b) Nồng độ CM của Ba(OH)2 sau phản ứng, coi thể tích dung dịch không thay đổi.
Hướng dẫn giải:
a) Số mol CO2 = 1,12 : 22,4 = 0,05(mol).
Số mol Ba(OH)2 = 0,101it. 2mol/lit = 0,20mol.
So sánh số mol của hai chất thấy rằng Ba(OH)2 dư, do đó chỉ tạo ra BaCO3
Ba(OH)2 + CO2 → BaCO3↓ + H2O
0,05mol 0,05mol 0,05mol
Khối lượng muấi thu được sau phản ứng là:
0,05 x 197 = 9,85 (gam).
b) Chất dư là Ba(OH)2
Sô mol Ba(OH)2 dư là: 0,20 - 0,05 = 0,15 (mol)
Nồng độ Ba(OH)2 dư là: 0,15 : 0,1 = 1,50M
Bài 28. Hoàn thành dãy biến hóa hóa học sau, kèm theo điều kiện, nếu có.
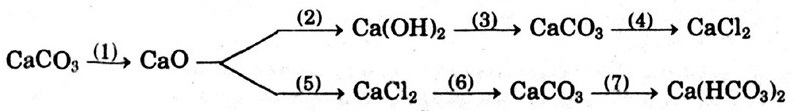 Hướng dẫn giải:
CaCO3
Hướng dẫn giải:
CaCO3  CaO + CO2↑ (1)
CaO + H2O → Ca(OH)2 (2)
Ca(OH)2 + CO2 → CaCO3↓ + H2O (3)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑ (4)
CaO+ 2HCl → CaCl2 + H2O (5)
CaCl2 + NaCO3 → CaCO3↓ + 2NaCl (6)
CaCO3 + CO2 + H2O → Ca(HCO3)2 (7)
Bài 29. Hãy viết các phương trình phản ứng giữa NaOH với 0,1mol H2SO4.Nhận xét về các điều kiện của phản ứng.
Hướng dẫn giải:
a) Tạo ra muối axit.
NaOH + H2SO4 → NaHSO4 + H2O
0,1mol 0,1mol
Nhận xét: Phản ứng chỉ tạo ra muối axit khi số mol NaOH nhỏ hơn hay bằng 0,1mol.
b) Tạo ra muối trung hòa.
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,2 0,1
Nhận xét: Phản ứng chỉ tạo ra muối trung hòa khi số mol NaOH lớn hơn hay bằng 0,2mol.
c) Tạo ra hỗn hợp cả hai muối.
NaOH + H2SO4 → NaHSO4 + 2H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
Nhận xét: Phản ứng tạo ra hỗn hợp hai muối khi số mol NaOH lớn hơn 0,1mol, nhưng nhỏ hơn 0,2mol .
Bài 30. Cho dung dịch hỗn hợp A gồm HCl 0,1M và H2SO4 0,1M cần bao nhiêu ml dung dịch NaOH 1M để trung hòa 100ml dung dịch A?
Hướng dẫn giải:
Các phương trình hóa học
HCl + NaOH → NaCl + H2O (1)
1mol 1mol
H2SO4 + 2NaOH → Na2SO4 + 2H2O (2)
1mol 2mol
NHCl = 0,1.0,1 = 0,01 (mol);
CaO + CO2↑ (1)
CaO + H2O → Ca(OH)2 (2)
Ca(OH)2 + CO2 → CaCO3↓ + H2O (3)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑ (4)
CaO+ 2HCl → CaCl2 + H2O (5)
CaCl2 + NaCO3 → CaCO3↓ + 2NaCl (6)
CaCO3 + CO2 + H2O → Ca(HCO3)2 (7)
Bài 29. Hãy viết các phương trình phản ứng giữa NaOH với 0,1mol H2SO4.Nhận xét về các điều kiện của phản ứng.
Hướng dẫn giải:
a) Tạo ra muối axit.
NaOH + H2SO4 → NaHSO4 + H2O
0,1mol 0,1mol
Nhận xét: Phản ứng chỉ tạo ra muối axit khi số mol NaOH nhỏ hơn hay bằng 0,1mol.
b) Tạo ra muối trung hòa.
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,2 0,1
Nhận xét: Phản ứng chỉ tạo ra muối trung hòa khi số mol NaOH lớn hơn hay bằng 0,2mol.
c) Tạo ra hỗn hợp cả hai muối.
NaOH + H2SO4 → NaHSO4 + 2H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
Nhận xét: Phản ứng tạo ra hỗn hợp hai muối khi số mol NaOH lớn hơn 0,1mol, nhưng nhỏ hơn 0,2mol .
Bài 30. Cho dung dịch hỗn hợp A gồm HCl 0,1M và H2SO4 0,1M cần bao nhiêu ml dung dịch NaOH 1M để trung hòa 100ml dung dịch A?
Hướng dẫn giải:
Các phương trình hóa học
HCl + NaOH → NaCl + H2O (1)
1mol 1mol
H2SO4 + 2NaOH → Na2SO4 + 2H2O (2)
1mol 2mol
NHCl = 0,1.0,1 = 0,01 (mol); 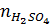 = 0,1 . 0,1 = 0,01(mol)
NNaOH = 0,01 + 0,02 = 0,03 (mol).
VNaOH = 0,03 : 1 = 0,03 lit
Bài 31. Trả lời “có” nếu xảy ra phản ứng hóa học hoặc “không” nếu không xảy ra phản ứng vào các ô trống trong bảng sau:
= 0,1 . 0,1 = 0,01(mol)
NNaOH = 0,01 + 0,02 = 0,03 (mol).
VNaOH = 0,03 : 1 = 0,03 lit
Bài 31. Trả lời “có” nếu xảy ra phản ứng hóa học hoặc “không” nếu không xảy ra phản ứng vào các ô trống trong bảng sau:
| |
NaCl |
NH4NO3 |
Na2CO3 |
Na2SO4 |
| HCl |
|
|
|
|
| NaOH |
|
|
|
|
| BaCl2 |
|
|
|
|
| H2SO4 |
|
|
|
|
Viết các phương trình hóa học xảy ra.
Hướng dẫn giải:
| |
NaCl |
NH4NO3 |
Na2CO3 |
Na2SO4 |
| HCl |
|
|
có |
|
| NaOH |
|
có |
|
|
| BaCl2 |
|
|
có |
có |
| H2SO4 |
có |
|
có |
|
Viết các phương trình hóa học xảy ra.
2HCl +Na2CO3 → 2NaCl + H2O + CO2↑
NaOH + NH4NO3 → NH3↑ + H2O + NaNO3
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
H2SO4 + NaCl → HCl + NaHSO4
2H2SO4 + Na2CO3 → H2O + CO2↑ + 2NaHSO4
Bài 32. Điều kiện để xảy ra phản ứng trao đổi giữa các dung dịch là gì? Cho các ví dụ minh họa.
Hướng dẫn giải:
Điều kiện để xảy ra phản ứng trao đổi giữa các dung dịch là:
a) Tạo ra chất khí: dung dịch natri cacbonat (Na2CO3) hoặc dung dịch natri sunfit (Na2SO3) tác dụng với dung dịch axit (HCl hay H2SO4).
Na2CO3 + 2HCl →2NaCl + H2O+ CO2↑
Na2SO3 + 2HCl → 2NaCl + H2O + SO2↑
b) Tạo ra chất không tan: dung dịch muối bari clorua với dung dịch axit sunfuric, hay muối natri sunfat.
BaCl2 + H2SO4 → 2HC1 + BaSO4↓
BaCl2 + Na2SO4 → 2NaCl + BaSO4↓
Bài 33. Nhận biết các hóa chất Na2SO4, AgNO3, MgCl2, Na2CO3 bằng phương pháp hóa học, viết các phương trình phản ứng.
Hướng dẫn giải:
Bước 1. Dùng thuốc thử HCl, nếu có khí thoát ra là Na2CO3, nếu có kết tủa trắng là AgNO3
2HCl + Na2CO3 → 2NaCl + CO2↑ + H2O
HCl +AgNO3 → AgCl↓ +HNO3
Bước 2. Các muối còn lại gồm Na2SO4, MgCl2 dùng NaOH để thử, nếu có kết tủa trắng thì đó là MgCl2, nếu không có hiện tượng gì thì đó là Na2SO4.
2NaOH + MgCl2 → Mg(OH)2↓ + 2NaCl
Bài 34. Cho các hóa chất: CuCl2, Mg(NO3)2, CaCO3, Na2SO3. Trong số cá chất đã cho, chất nào có thể tác dụng với:
a) Dung dịch NaOH.
b) Dung dịch HCl.
c) Dung dịch AgNO3
Hướng dẫn giải:
a) Phản ứng với dung dịch NaOH
Mg(NO3)2+ 2NaOH → Mg(OH)2↓ + 2NaNO3
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
b) Phản ứng với dung dịch HCl.
CaCO3 + 2HC1 → CaCl2 + CO2↑ + H2O
Na2SO3 + 2HC1 → 2NaCl + SO2↑ + H2O
c) Phản ứng với dung dịch AgNO3
CuCl2 + 2AgNO3 → 2AgCl↓ + Cu(NO3)2
Bài 35. Cho bảng sau, điền dấu x nếu xảy ra phản ứng và dấu 0 nếu không xảy ra phản ứng hóa học. Viết các phương trình phản ứng hóa học.
| |
Na2CO3 |
KCl |
Na2SO4 |
NaNO3 |
| Pb(NO3)2 |
|
|
|
|
| BaCl2 |
|
|
|
|
Hướng dẫn giải:
| |
Na2CO3 |
KCl |
Na2SO4 |
NaNO3 |
| Pb(NO3)2 |
x |
x |
x |
0 |
| BaCl2 |
x |
0 |
x |
0 |
Các phương trình phản ứng hóa học:
Pb(NO3)2 + Na2CO3 → PbCO3↓ + 2NaNO3
Pb(NO3)2 + 2KC1 → PbCl2↓ + 2KNO3
Pb(NO3)2 + Na2SO4 → PbSO4↓ + 2NaNO3
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Bài 36. Cho 100ml dung dịch CaCl2 0,20M tác dụng với 100ml dung dịch AgNO3 0,10M.
a) Nêu hiện tượng quan sát được và phương trình hóa học xảy ra.
b) Tính khối lượng chất rắn sinh ra.
c) Tính nồng độ mol/l của chất còn dư sau phản ứng. Coi thể tích thu được bằng tổng thể tích của hai dung dịch ban đầu.
Hướng dẫn giải:
a) Hiện tượng quan sát được và phương trình hóa học.
Xuất hiện kết tủa trắng. Phương trình hóa học:
CaCl2 + 2AgNO3 → 2AgCl↓ + Ca(NO3)2
0,005mol 0,01mol 0,01mol 0,005mol
b) Khối lượng chất rắn sinh ra:
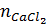 = 0,2 . 0,1 = 0,02(mol)
= 0,2 . 0,1 = 0,02(mol)
 = 0,1. 0,1 = 0,01(mol)
Chất phản ứng hết là AgNO3, số mol AgCl = 0,01mol
Suy ra mAgCl = 143,5 x 0,01 = 1,435 (g).
Số liệu bài đã cho chính xác đến 0,01g cho nên cần làm tròn số liệu đã tính toán.
Khối lượng AgNO3 thu được ≈ 1.44(g).
c) Chất còn dư là CaCl2
= 0,1. 0,1 = 0,01(mol)
Chất phản ứng hết là AgNO3, số mol AgCl = 0,01mol
Suy ra mAgCl = 143,5 x 0,01 = 1,435 (g).
Số liệu bài đã cho chính xác đến 0,01g cho nên cần làm tròn số liệu đã tính toán.
Khối lượng AgNO3 thu được ≈ 1.44(g).
c) Chất còn dư là CaCl2
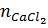 = 0,02 - 0,005 = 0,015 (mol).
= 0,02 - 0,005 = 0,015 (mol).
 =
= 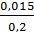 = 0,075M.
Bài 37. Hãy nhận biết các cặp chất sau bằng phương pháp hóa học.
a) NaCl và Na2CO3.
b) HCl và H2SO4.
c) NaOH và Ba(OH)2
Hướng dẫn giải:
a) Nhỏ axit HCl vào hai dung dịch, nếu có khí thoát ra thì đó là Na2CO3 chất còn lại là NaCl.
2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
b) Dùng dung dịch BaCl2 dể thử, nếu có kết tủa trắng đó là H2SO4, chất không có hiện tượng gì thì đó là HCl.
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
c) Dùng dung dịch muối Na2SO4 để thử, nếu xuất hiện kết tủa trắng thì đó là Ba(OH)2, chất không có hiện tượng gì thì đó là NaOH.
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH
Bài 38. Cho một hỗn hợp khí A gồm 2,00mol CO2, 1,00mol SO2, 0,50 mol CO, 0,30 mol H2 và 0,20 mol O2.
a) Tính khối lượng mol trung bình của hỗn hợp A.
b) Hỗn hợp A nặng hay nhẹ hơn không khí.
Hướng dẫn giải:
a) Tính khối lượng mol trung bình của hỗn hợp A.
= 0,075M.
Bài 37. Hãy nhận biết các cặp chất sau bằng phương pháp hóa học.
a) NaCl và Na2CO3.
b) HCl và H2SO4.
c) NaOH và Ba(OH)2
Hướng dẫn giải:
a) Nhỏ axit HCl vào hai dung dịch, nếu có khí thoát ra thì đó là Na2CO3 chất còn lại là NaCl.
2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
b) Dùng dung dịch BaCl2 dể thử, nếu có kết tủa trắng đó là H2SO4, chất không có hiện tượng gì thì đó là HCl.
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
c) Dùng dung dịch muối Na2SO4 để thử, nếu xuất hiện kết tủa trắng thì đó là Ba(OH)2, chất không có hiện tượng gì thì đó là NaOH.
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH
Bài 38. Cho một hỗn hợp khí A gồm 2,00mol CO2, 1,00mol SO2, 0,50 mol CO, 0,30 mol H2 và 0,20 mol O2.
a) Tính khối lượng mol trung bình của hỗn hợp A.
b) Hỗn hợp A nặng hay nhẹ hơn không khí.
Hướng dẫn giải:
a) Tính khối lượng mol trung bình của hỗn hợp A.
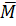 A =
A = 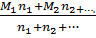 =
= 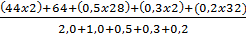 = 43,25
b) Không khí có
= 43,25
b) Không khí có  = 29 <
= 29 < A = 43,25 suy ra A nặng hơn không khí.
Bài 39. Cho hỗn hợp gồm 11,0 gam Al và Fe tác dụng vừa đủ với Vmol axit H2SO4 2M thì thu được 8,96 lít khí hiđro (đktc).
a) Viết các phương trình phản ứng hóa học.
b) Tính khối lượng từng kim loại trong hỗn hợp.
c) Tính V.
Hướng dẫn giải:
a) Viết các phương trình phản ứng hóa học.
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
xmol 1,5xmol 1,5xmol
Fe + H2SO4 →FeSO4 + H2↑
ymol ymol ymol
b) Tính m và khối lượng từng kim loại trong hỗn hợp.
Khối lượng hai kim loại = 27x + 56y = 11,0 (I)
Tổng số mol hiđro = 1,5x + y = 8,96 : 22,4 = 0,4 (II)
Kết quả x = 0,2 mol, y = 0,1 mol.
MFe = 0,1 .56 = 5,6 (g), mAl = 0,2 . 27 = 5,4 (g).
c) Tính V.
Nhận xét số mol H2SO4 = số mol H2 = 0,4 (mol).
Thể tích H2SO4 2M = 0,4 : 2 = 0,2 (lit).
Bài 40. Viết các phương trình phản ứng hóa học để điều chế muối MgCl2 bằng 7 cách khác nhau.
Hướng dẫn giải:
Viết các phương trình phản ứng hóa học để điều chế muối MgCl2 bằng 7 cách khác nhau.
1. Kim loại tác dụng với axit
Mg + 2HCl → MgCl2 + H2↑
2. Kim loại tác dụng với muối
Mg + CuCl2 → MgCl2 + Cu
3. Oxit kim loại tác dụng với axit
MgO + 2HCl→ MgCl2 + H2O
4. Hiđroxit tác dụng với axit
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
5. Hai muối tan tác dụng với nhau
BaCl2 + MgSO4 → MgCl2 + BaSO4↓
6. Muối tác dụng với axit
MgCO3 + 2HCl → MgCl2 + H2O + CO2↑
7. Kim loại tác dụng với phi kim
Mg + Cl2 → MgCl2
Bài 41. Nhận biết các chất sau bằng phương pháp hóa học: CO2, SO2, O2. Viết các phương trình hóa học.
Hướng dẫn giải:
Bước l: Dùng tàn đóm đỏ đưa vào từng bình khí, nếu tàn đóm bùng cháy thì đó là khí oxi (O2).
Bước 2: Hai khí còn lại dẫn qua bình đựng nước brom, nếu mất màu nâu đỏ thì đó là khí SO2 nếu không có hiện tượng gì thì đó là CO2.
A = 43,25 suy ra A nặng hơn không khí.
Bài 39. Cho hỗn hợp gồm 11,0 gam Al và Fe tác dụng vừa đủ với Vmol axit H2SO4 2M thì thu được 8,96 lít khí hiđro (đktc).
a) Viết các phương trình phản ứng hóa học.
b) Tính khối lượng từng kim loại trong hỗn hợp.
c) Tính V.
Hướng dẫn giải:
a) Viết các phương trình phản ứng hóa học.
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
xmol 1,5xmol 1,5xmol
Fe + H2SO4 →FeSO4 + H2↑
ymol ymol ymol
b) Tính m và khối lượng từng kim loại trong hỗn hợp.
Khối lượng hai kim loại = 27x + 56y = 11,0 (I)
Tổng số mol hiđro = 1,5x + y = 8,96 : 22,4 = 0,4 (II)
Kết quả x = 0,2 mol, y = 0,1 mol.
MFe = 0,1 .56 = 5,6 (g), mAl = 0,2 . 27 = 5,4 (g).
c) Tính V.
Nhận xét số mol H2SO4 = số mol H2 = 0,4 (mol).
Thể tích H2SO4 2M = 0,4 : 2 = 0,2 (lit).
Bài 40. Viết các phương trình phản ứng hóa học để điều chế muối MgCl2 bằng 7 cách khác nhau.
Hướng dẫn giải:
Viết các phương trình phản ứng hóa học để điều chế muối MgCl2 bằng 7 cách khác nhau.
1. Kim loại tác dụng với axit
Mg + 2HCl → MgCl2 + H2↑
2. Kim loại tác dụng với muối
Mg + CuCl2 → MgCl2 + Cu
3. Oxit kim loại tác dụng với axit
MgO + 2HCl→ MgCl2 + H2O
4. Hiđroxit tác dụng với axit
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
5. Hai muối tan tác dụng với nhau
BaCl2 + MgSO4 → MgCl2 + BaSO4↓
6. Muối tác dụng với axit
MgCO3 + 2HCl → MgCl2 + H2O + CO2↑
7. Kim loại tác dụng với phi kim
Mg + Cl2 → MgCl2
Bài 41. Nhận biết các chất sau bằng phương pháp hóa học: CO2, SO2, O2. Viết các phương trình hóa học.
Hướng dẫn giải:
Bước l: Dùng tàn đóm đỏ đưa vào từng bình khí, nếu tàn đóm bùng cháy thì đó là khí oxi (O2).
Bước 2: Hai khí còn lại dẫn qua bình đựng nước brom, nếu mất màu nâu đỏ thì đó là khí SO2 nếu không có hiện tượng gì thì đó là CO2.
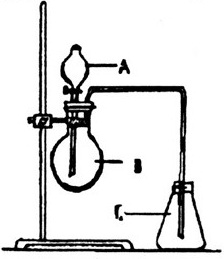
Bài 42. Cho dụng cụ như hình vẽ:
Có thể dùng dụng cụ này để điều chế trong phòng thí nghiệm chất khí nào trong số các khí sau: Cl2, H2, O2, HCl, CO2? Nếu được, ghi rõ công thức hóa học các hóa chất A, B, C cho từng trường hợp và viết các phương trình hóa học của phản ứng.
Hướng dẫn giải:
Dụng cụ đã cho là dụng cụ điều chế chất khí từ chất lỏng và chất rắn, có thể điều chế khí Cl2 và HCl trong số 5 khí đã cho.
Trường hợp điều chế Clo: A là HCl đặc, B là KMnO4(MnO2), C là Cl2.
Các phương trình phản ứng hóa học:
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
hoặc 4HCl + MnO2 → MnCl2 + 2H2O + Cl2↑
Trường hợp điều chế HCl: A là dung dịch H2SO4 đặc, B là NaCl tinh thể, C là HCl.
NaCl + H2SO4 → NaHSO4 + HCl. |
 |
© Bản quyền thuộc về
Bài kiểm tra. Ghi rõ nguồn Bài kiểm tra.com khi sao chép nội dung này.