Giải bài tập Hóa học 9, Bài 2: Một số oxit quan trọng
2019-06-27T21:33:59-04:00
2019-06-27T21:33:59-04:00
Giải bài tập Hóa học 9, Bài 2: Một số oxit quan trọng
/themes/cafe/images/no_image.gif
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Thứ năm - 27/06/2019 21:33
Giải bài tập Hóa học 9, Bài 2: Một số oxit quan trọng
BÀI 2. Một số oxit quan trọng
A - Canxi oxit
Bài 1. Bằng phương pháp hóa học nào có thể nhận biết dược từng chất trong mỗi dãy chất sau:
a) Hai chất rắn màu trắng là CaO và Na2O.
b) Hai chất khí không màu là CO2 và O2.
Viết các phương trình phản ứng. |
|
Hướng dẫn giải:
a) Nhận biết hai chất rắn màu trắng là CaO và Na2O bằng phương pháp hóa học.
+ Cho hai chất rắn tác dụng với nước:
CaO + H2O → Ca(OH)2
Na2O + H2O → 2NaOH
Dẫn khí CO2 từ từ đi qua từng dung dịch, nếu xuất hiện kết tủa trắng thì đó là Ca(OH)2, nếu không có hiện tượng gì thì đó là NaOH.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
CO2 + 2NaOH → Na2CO3 + H2O
b) Hai chất khí không màu là CO2 và O2. Sử dụng nước vôi trong làm thuốc thử để nhận biết khí CO2 do xuất hiện kết tủa của CaCO3, nếu không có hiện tượng gì thì đó là khí oxi.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Bài 2. Hãy nhận biết từng chất trong mỗi nhóm chất sau bằng phương pháp hóa học:
a) CaO, CaCO3; b) CaO, CuO.
Viết các phương trình phản ứng.
Hướng dẫn giải:
a) CaCO3 và CaO có thể dùng dung dịch HCl để thử. Nếu xuất hiện bọt khí thì đó là CaCO3, nếu không có khí thoát ra thì đó là CaO.
CaCO3 + 2HCl → CaCl2 + H2O + CO2(khí)
b) CaO, CuO có thể dùng nước để thử. Nếu có phản ứng với nước thì đó là CaO, CuO không phản ứng.
CaO + H2O → Ca(OH)2
Bài 3. 200ml dung dịch HCl có nồng độ 3,5mol/l hòa tan vừa đủ 20g hỗn hợp hai oxit CuO và Fe2O3.
a) Viết các phương trình phản ứng.
b) Tính khối lượng của mỗi oxit có trong hổn hợp ban đầu.
Hướng dẫn giải:
a) Các phương trình hóa học
CuO + 2HCl → CuCl2 + H2O
1 mol 2 mol
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
1 mol 6 mol
b) Khối lượng của mỗi oxit:
Đặt x, y lần lượt là số mol CuO và Fe2O3 trong hỗn hợp.
Khối lượng hỗn hợp = 80x + 160y = 20 (I)
Số mol HCl = 2x + 6y = 3,5 . 0,2 = 0,7 (II)
Giải hệ phương trình ta được y = 0,1, x = 0,05
Khối lượng CuO = 0,05 . 80 = 4 (g).
Khối lượng Fe2O3 = 0,1 . 160 = 16 (g)
Bài 4. Biết 2,241ít khí CO2 (đktc) tác dụng vừa đủ với 200ml dung dịch Ba(OH)2, sản phẩm là BaCO3 và H2O.
a) Viết phương trình phản ứng.
b) Tính nồng độ mol của dung dịch Ba(OH)2 đã dùng.
c) Tính khối lượng chất kết tủa thu được.
Hướng dẫn giải:
a) Viết phương trình phản ứng:
CO2 + Ba(OH)2 → BaCO3↓ + H2O
1 mol 1 mol 1 mol
b) Nồng độ mol của dung dịch Ba(OH)2
Số mol CO2 = 2,24 : 22,4 = 0,1 = Số mol Ba(OH)2
CM =  =
= 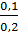 = 0,5 M
c) Khối lượng chất kết tủa:
Khối lượng BaCO3 = 0,1 . 197 = 19,7 (g)
B. Lưu huỳnh đioxit
Bài 1. Viết phương trình hóa học cho mỗi biến đổi sau:
= 0,5 M
c) Khối lượng chất kết tủa:
Khối lượng BaCO3 = 0,1 . 197 = 19,7 (g)
B. Lưu huỳnh đioxit
Bài 1. Viết phương trình hóa học cho mỗi biến đổi sau:
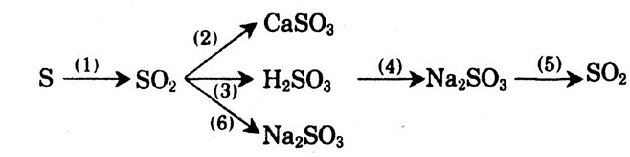 Hướng dẫn giải:
S + O2 → SO2 (1)
SO2 + CaO → CaSO3 (2)
SO2 + H2O → H2SO3 (3)
H2SO3 + 2NaOH → Na2SO3 + 2H2O (4)
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑ (5)
SO2 + 2NaOH → Na2O3 + H2O (6)
Bài 2. Hãy nhận biết từng chất trong mỗi nhổm chất sau bằng phương pháp hóa học:
a) Hai chất rắn màu trắng là CaO và P2O5.
b) Hai chất khí không màu là SO2 và O2.
Viết các phương trình hóa học.
Hướng dẫn giải:
a) CaO và P2O5 là một oxit bazơ và một oxit axit. Có thể cho 2 oxit tác dụng với nước ở hai cốc riêng biệt. Dùng quỳ tím để thử, nếu có màu xanh thì chất ban đầu là CaO. Nếu quỳ chuyển sang màu đỏ thì chất ban đầu là P2O5.
CaO + H2O → Ca(OH)2 dung dịch bazơ
P2O5 + 3H2O → 2H3PO4 dung dịch axit
b) SO2 và O2 có thể dùng tàn đóm đỏ để thử và nhận ra oxi. Khí còn lại thêm nước cất, lắc và thử dung dịch bằng quỳ tím, quỳ tím chuyển sang màu đỏ thì khí ban đầu là SO2.
SO2 + H2O → H2SO3 dung dịch axit sunfurơ
Bài 3. Có những khí ẩm (khí có lẫn hơi nước): cacbon đioxit, hiđro, oxi, lưu huỳnh đioxit. Khí nào có thể được làm khô bằng canxi oxit? Giải thích.
Hướng dẫn giải:
Nguyên tắc làm khô các chất khí là chất làm khô chỉ giữ lại hơi nước mà không tác dụng với chất được làm khô.
CaO là một oxit bazơ, chỉ làm khô được: H2, O2.
CaO không thể làm khô hai oxit axit SO2 và CO2 vì vi pham nguyên tắc trên.
CaO có thể tác dụng với các oxit axit.
CaO + CO2 → CaCO3
CaO + SO2 → CaSO3
Bài 4. Có những chất khí sau: CO2, H2,O2, SO2, N2. Hãy cho biết chất nào có tính chất sau:
a) Nặng hơn không khí.
b) Nhẹ hơn không khí.
c) Cháy được trong không khí
d) Tác dụng với nước tạo thành dung dịch axit.
e) Làm đục nước vôi trong.
g) Đổi màu giấy quỳ tím ẩm thành đỏ.
Hướng dẫn giải:
a) Nặng hơn không khí: CO2,O2, SO2
b) Nhẹ hơn không khí: H2, N2.
c) Cháy được trong không khí: H2
d) Tác dụng với nước tạo thành dung dịch axit: CO2, SO2,
e) Làm đục nước vôi trong: CO2, SO2.
g) Đổi màu giấy quỳ tím ẩm thành đỏ: CO2, SO2.
Bài 5. Khí lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây:
a) K2SO3 và H2SO4. b) K2SO4 và HCl. c) Na2SO3 và NaOH
d) Na2SO4 và CuCl2. e) Na2SO3 và NaCl.
Hướng dẫn giải: Chọn phương án a.
Bài 6. Dẫn 112ml khí SO2 (đktc) đi qua 700ml dung dịch Ca(OH)2 có nồng độ 0,01 mol/l.
a) Viết phương trình hóa học.
b) Tính khối lượng các chất sau phản ứng.
Hướng dẫn giải:
nSO2 =
Hướng dẫn giải:
S + O2 → SO2 (1)
SO2 + CaO → CaSO3 (2)
SO2 + H2O → H2SO3 (3)
H2SO3 + 2NaOH → Na2SO3 + 2H2O (4)
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑ (5)
SO2 + 2NaOH → Na2O3 + H2O (6)
Bài 2. Hãy nhận biết từng chất trong mỗi nhổm chất sau bằng phương pháp hóa học:
a) Hai chất rắn màu trắng là CaO và P2O5.
b) Hai chất khí không màu là SO2 và O2.
Viết các phương trình hóa học.
Hướng dẫn giải:
a) CaO và P2O5 là một oxit bazơ và một oxit axit. Có thể cho 2 oxit tác dụng với nước ở hai cốc riêng biệt. Dùng quỳ tím để thử, nếu có màu xanh thì chất ban đầu là CaO. Nếu quỳ chuyển sang màu đỏ thì chất ban đầu là P2O5.
CaO + H2O → Ca(OH)2 dung dịch bazơ
P2O5 + 3H2O → 2H3PO4 dung dịch axit
b) SO2 và O2 có thể dùng tàn đóm đỏ để thử và nhận ra oxi. Khí còn lại thêm nước cất, lắc và thử dung dịch bằng quỳ tím, quỳ tím chuyển sang màu đỏ thì khí ban đầu là SO2.
SO2 + H2O → H2SO3 dung dịch axit sunfurơ
Bài 3. Có những khí ẩm (khí có lẫn hơi nước): cacbon đioxit, hiđro, oxi, lưu huỳnh đioxit. Khí nào có thể được làm khô bằng canxi oxit? Giải thích.
Hướng dẫn giải:
Nguyên tắc làm khô các chất khí là chất làm khô chỉ giữ lại hơi nước mà không tác dụng với chất được làm khô.
CaO là một oxit bazơ, chỉ làm khô được: H2, O2.
CaO không thể làm khô hai oxit axit SO2 và CO2 vì vi pham nguyên tắc trên.
CaO có thể tác dụng với các oxit axit.
CaO + CO2 → CaCO3
CaO + SO2 → CaSO3
Bài 4. Có những chất khí sau: CO2, H2,O2, SO2, N2. Hãy cho biết chất nào có tính chất sau:
a) Nặng hơn không khí.
b) Nhẹ hơn không khí.
c) Cháy được trong không khí
d) Tác dụng với nước tạo thành dung dịch axit.
e) Làm đục nước vôi trong.
g) Đổi màu giấy quỳ tím ẩm thành đỏ.
Hướng dẫn giải:
a) Nặng hơn không khí: CO2,O2, SO2
b) Nhẹ hơn không khí: H2, N2.
c) Cháy được trong không khí: H2
d) Tác dụng với nước tạo thành dung dịch axit: CO2, SO2,
e) Làm đục nước vôi trong: CO2, SO2.
g) Đổi màu giấy quỳ tím ẩm thành đỏ: CO2, SO2.
Bài 5. Khí lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây:
a) K2SO3 và H2SO4. b) K2SO4 và HCl. c) Na2SO3 và NaOH
d) Na2SO4 và CuCl2. e) Na2SO3 và NaCl.
Hướng dẫn giải: Chọn phương án a.
Bài 6. Dẫn 112ml khí SO2 (đktc) đi qua 700ml dung dịch Ca(OH)2 có nồng độ 0,01 mol/l.
a) Viết phương trình hóa học.
b) Tính khối lượng các chất sau phản ứng.
Hướng dẫn giải:
nSO2 = 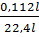 = 0,005(mol); nCa(OH)2, = 0,01 x 0,7 = 0,007(mol)
a) Phương trình phản ứng:
SO2 + Ca(OH)2 → CaSO3 + H2O
1mol 1mol 1mol
0,005mol 0,005mol 0,005mol
⇒ Ca(OH)2 dư 0,02mol
b) Khối lượng các chất sau phản ứng:
mCa(OH)2 = 0,02 x 74 = l,48(g); mCaSO3 = 0,005 x (40 + 32 + 48) = 0,6(gam)
= 0,005(mol); nCa(OH)2, = 0,01 x 0,7 = 0,007(mol)
a) Phương trình phản ứng:
SO2 + Ca(OH)2 → CaSO3 + H2O
1mol 1mol 1mol
0,005mol 0,005mol 0,005mol
⇒ Ca(OH)2 dư 0,02mol
b) Khối lượng các chất sau phản ứng:
mCa(OH)2 = 0,02 x 74 = l,48(g); mCaSO3 = 0,005 x (40 + 32 + 48) = 0,6(gam)
© Bản quyền thuộc về
Bài kiểm tra. Ghi rõ nguồn Bài kiểm tra.com khi sao chép nội dung này.

