Bài 1. Hãy viết hai phương trình hóa học trong mỗi trường hợp sau đây:
- Kim loại tác dụng với oxi tạo thành oxit bazơ.
- Kim loại tác dụng với phi kim tạo thành muối.
- Kim loại tác dụng với dung dịch axit tạo thành muối và giải phóng khí hiđro.
- Kim loại tác dụng với dung dịch muối tạo thành muối mới và kim loại mới.
Hướng dẫn giải:
- Kim loại tác dụng với oxi tạo thành oxit bazơ.
4Na + O2 → 2Na2O
2Mg + O2 → 2MgO
- Kim loại tác dụng với phi kim tạo thành muối.
2Fe + 3Cl2 → 2FeCl3
Mg + Cl2 → MgCl2
- Kim loại tác dụng với dung dịch axit tạo thành muối và giải phóng khí hiđro.
Fe + 2HCl →FeCl2 + H2↑
Mg + 2HCl → MgCl2 + H2↑
- Kim loại tác dụng với dung dịch muối tạo thành muối mới và kim loại mới.
Fe + CuSO4 → FeSO4 + Cu
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Bài 2. Hãy xét xem các cặp chất sau đây, cặp chất nào có phản ứng? Không có phản ứng?
a) Al và khí Cl2; b) Al và HNO3 đặc nguội;
c) Fe và H2SO4 đặc nguội; d) Fe và dung dịch Cu(NO3)2
Viết các phương trình hóa học (nếu có).
Hướng dẫn giải:
a) Al và khí Cl2
2Al + 3Cl2 → 2AlCl3
b) Al và HNO3 đặc nguội không phản ứng.
c) Fe và H2SO4 đặc nguội không phản ứng
d) Fe và dung dịch Cu(NO3)2
Fe + Cu(NO3)2 → Cu + Fe(NO3)2
Bài 3. Có 4 kim loại: A, B, C, D đứng sau Mg trong dãy hoạt động hóa học. Biết rằng:
- A và B tác dụng với dung dịch HCl giải phóng khí hiđro.
- C và D không có phản ứng với dung dịch HCl.
- B tác dụng với dung dịch muối của A và giải phóng A.
- D tác dụng được với dung dịch muối của C và giải phóng C.
Hãy xác định thứ tự sắp xếp nào sau đây là đúng (theo chiều hoạt động hóa học giảm dần):
a) B, D, C, A; b) D, A, B, C; c) B, A, D, C;
d) A B, C, D; e) C, B, D, A
Hướng dẫn giải:
- A và B tác dụng với dung dịch HCl giải phóng khí hiđro, chứng tỏ A và B đứng trước H trong dãy hoạt động hóa học.
- C và D không có phản ứng với dung dịch HCl, chứng tỏ C và D đứng sau H trong dãy hoạt động hóa học.
- B tác dụng với dung dịch muối của A và giải phóng A, chứng tỏ B đứng trước A, theo chiều hoạt động hóa học giảm dần.
- D tác dụng được với dung dịch muối của C và giải phóng C, chứng tỏ D đứng trước C theo chiều hoạt động hóa học giảm dần.
Vậy phương án đúng là c: B, A, D, C.
Bài 4. Viết phương trình hóa học biểu diễn sự chuyển hóa sau đây:
a) Al  Al2O3
Al2O3  AlCl3
AlCl3  Al(OH)3
Al(OH)3  Al2O3
Al2O3  Al
Al  AlCl3
AlCl3
b) Fe  FeSO4
FeSO4  Fe(OH)2
Fe(OH)2  FeCl2
FeCl2
c) FeCl3  Fe(OH)3
Fe(OH)3 Fe2O3
Fe2O3  Fe
Fe  Fe3O4
Hướng dẫn giải:
a) Dãy chuyển hóa của nhôm:
4Al + 3O2 → 2Al2O3 (1)
Al2O3 + 6HCl →2AlCl3 + 3H2O (2)
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl (3)
2Al(OH)3
Fe3O4
Hướng dẫn giải:
a) Dãy chuyển hóa của nhôm:
4Al + 3O2 → 2Al2O3 (1)
Al2O3 + 6HCl →2AlCl3 + 3H2O (2)
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl (3)
2Al(OH)3 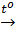 Al2O3 + 3H2O (4)
2Al2O3
Al2O3 + 3H2O (4)
2Al2O3 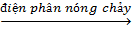 4Al + 3O2↑ (5)
2Al + 3Cl2 → 2AlCl3 (6)
b) Dãy chuyển hóa của sắt:
Fe + H2SO4 loãng → FeSO4 + H2↑ (1)
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4 (2)
Fe(OH)2 + 2HCl → FeCl2 + 2H2O (3)
c) Dãy chuyển hóa của hợp chất sắt:
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl (1)
2Fe(OH)3
4Al + 3O2↑ (5)
2Al + 3Cl2 → 2AlCl3 (6)
b) Dãy chuyển hóa của sắt:
Fe + H2SO4 loãng → FeSO4 + H2↑ (1)
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4 (2)
Fe(OH)2 + 2HCl → FeCl2 + 2H2O (3)
c) Dãy chuyển hóa của hợp chất sắt:
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl (1)
2Fe(OH)3 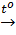 Fe2O3 + 3H2O (2)
Fe2O3 + 3CO
Fe2O3 + 3H2O (2)
Fe2O3 + 3CO 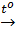 2Fe + 3CO2↑ (3)
3Fe + 2O2 → Fe3O4 (4)
Bài 5. Cho 9,2 gam một kim loại A phản ứng với khí clo dư tạo thành 23,4 gam muối. Hãy xác định kim loại A, biết rằng A có hóa trị I.
Hướng dẫn giải:
2A + Cl2 → 2ACl
2mol 1mol
Khối lượng Clo phản ứng = 23,4 - 9,2 = 14,2
Số mol Cl2 =
2Fe + 3CO2↑ (3)
3Fe + 2O2 → Fe3O4 (4)
Bài 5. Cho 9,2 gam một kim loại A phản ứng với khí clo dư tạo thành 23,4 gam muối. Hãy xác định kim loại A, biết rằng A có hóa trị I.
Hướng dẫn giải:
2A + Cl2 → 2ACl
2mol 1mol
Khối lượng Clo phản ứng = 23,4 - 9,2 = 14,2
Số mol Cl2 = 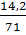 = 0,2 ⇒ Số mol A = 0,2 x 2 = 0,4 71
Khối lượng mol của A =
= 0,2 ⇒ Số mol A = 0,2 x 2 = 0,4 71
Khối lượng mol của A = 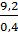 = 23 => A là Na.
Bài 6. Ngâm một lá sắt có khối lượng 2,5 gam trong 25ml dung dịch CuSO4 15% có khối lượng riêng là 1,12g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô thì cân nặng 2,58g
a) Hãy viết phương trình hóa học.
b) Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
Hướng dẫn giải:
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
56g 64g khối lượng tăng 8g
xg = 0,56g yg = 0,64g 0,08g
b) Tính nồng độ phần trăm cua các chất trong dung dịch sau plảm ứng m dung dịch sau phản ứng = m dung dịch ban đầu + mFe tan- mCu =
= (25 x 1,12) - 0,08 = 27,92 (g)
= 23 => A là Na.
Bài 6. Ngâm một lá sắt có khối lượng 2,5 gam trong 25ml dung dịch CuSO4 15% có khối lượng riêng là 1,12g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô thì cân nặng 2,58g
a) Hãy viết phương trình hóa học.
b) Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
Hướng dẫn giải:
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
56g 64g khối lượng tăng 8g
xg = 0,56g yg = 0,64g 0,08g
b) Tính nồng độ phần trăm cua các chất trong dung dịch sau plảm ứng m dung dịch sau phản ứng = m dung dịch ban đầu + mFe tan- mCu =
= (25 x 1,12) - 0,08 = 27,92 (g)
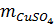 = 15% x (25 x 1,12) = 4,2 (g)
= 15% x (25 x 1,12) = 4,2 (g)
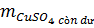 = 4,2 - (0,01 x 160) = 2,6 (g)
= 4,2 - (0,01 x 160) = 2,6 (g)
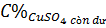 =
= 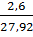 ≈ 9,31%
≈ 9,31%
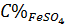 =
= 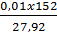 ≈ 5,44%
Bài 7. Cho 0,83gam hỗn hợp gồm nhôm và sắt tác dụng với dung dịch H2SO4 loãng dư. Sau phản ứng thu được 0,56 lít khí ở đktc.
a) Viết các phương trình hóa học.
b) Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
Hướng dẫn giải:
Đặt x và y lần lượt là số mol Al và Fe trong hỗn hợp.
a) Viết các phương trình hóa học
2AI + 3H2SO4 loãng, dư → Al2(SO4)3+ 3H2↑
xmol 1,5xmol
Fe + H2SO4 loãng, dư → FeSO4 + H2↑
ymol ymol
Theo các phương trình hóa học ta có:
Số mol H2 = 1,5x + y =
≈ 5,44%
Bài 7. Cho 0,83gam hỗn hợp gồm nhôm và sắt tác dụng với dung dịch H2SO4 loãng dư. Sau phản ứng thu được 0,56 lít khí ở đktc.
a) Viết các phương trình hóa học.
b) Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
Hướng dẫn giải:
Đặt x và y lần lượt là số mol Al và Fe trong hỗn hợp.
a) Viết các phương trình hóa học
2AI + 3H2SO4 loãng, dư → Al2(SO4)3+ 3H2↑
xmol 1,5xmol
Fe + H2SO4 loãng, dư → FeSO4 + H2↑
ymol ymol
Theo các phương trình hóa học ta có:
Số mol H2 = 1,5x + y = 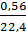 = 0,025 mol (I)
Khối lượng hai kim loại = 27x + 56y = 0,83 (II)
Giải hệ phương trình bậc nhất với hai ẩn số x và y
Nhân phương trình (I) với 18 rồi lấy (II) - (I) ta có:
38y = 0,83 - 0,45 = 0,38 ⇒ y = 0,01 và x = 0,01
% của Al =
= 0,025 mol (I)
Khối lượng hai kim loại = 27x + 56y = 0,83 (II)
Giải hệ phương trình bậc nhất với hai ẩn số x và y
Nhân phương trình (I) với 18 rồi lấy (II) - (I) ta có:
38y = 0,83 - 0,45 = 0,38 ⇒ y = 0,01 và x = 0,01
% của Al = 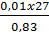 ≈ 32,53%
%Fe = 100% - 32,53% = 67,47%
≈ 32,53%
%Fe = 100% - 32,53% = 67,47%
![]() FeSO4
FeSO4 ![]() Fe(OH)2
Fe(OH)2 ![]() FeCl2
FeCl2