Giải bài tập Hóa học 9, Bài 4:Một số axit quan trọng
2019-06-27T22:50:07-04:00
2019-06-27T22:50:07-04:00
Giải bài tập Hóa học 9, Bài 4:Một số axit quan trọng
/themes/cafe/images/no_image.gif
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Thứ năm - 27/06/2019 22:47
Giải bài tập Hóa học 9, Bài 4:Một số axit quan trọng
Bài 1. Có những chất: CuO, BaCl2, Zn, ZnO. Chất nào nói trên tác dụng với dung dịch HCl và dung dịch H2SO4 loãng sinh ra:
a) Chất khí cháy được trong không khí?
b) Dung dịch có màu xanh lam?
c) Chất kết tủa màu trắng không tan trong nước và axit?
d) Dung dịch không màu và nước?
Viết tất cả các phương trình phản ứng.
Hướng dẫn giải:
a) Chất khí cháy được trong không khí ở đây là H2. Chỉ có Zn tác dụng với dung dịch axit HCl và dung dịch H2SO4 loãng, giải phóng khí H2
Zn+ 2HCl→ ZnCl2 + H2↑
Zn+ H2SO4 → ZnSO4 + H2↑
b) Dung dịch có màu xanh lam là màu của muối đồng II.
CuO + H2SO4 → CuSO4 + H2O
CuO + 2HCl → CuCl2 + H2O
màu xanh lam
c) Chất kết tủa màu trắng, không tan trong nước và axit, đó là BaSO4.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
d) Dung dịch không màu và nước là dung dịch ZnCl2 hay ZnSO4
ZnO + 2HCl → ZnCl2 + H2O
ZnO + H2SO4 → ZnSO4 + H2O
Bài 2. Sản xuất axit sunfuric trong công nghiệp cần phải có những nguyên
liệu chủ yếu nào? Hãy cho biết mục đích của mỗi công đoạn sản xuất axit sunfuric và dẫn ra những phản ứng hóa học?
Hướng dẫn giải:
Xem sách giáo khoa Hóa học 9.
Bài 3. Bằng cách nào có thể nhận biết được từng chất trong mỗi cặp chất sau theo phương pháp hóa học
a) Dung dịch HCl và dung dịch H2SO4;
b) Dung dịch NaCl và dung dịch Na2SO4.
c) Dung dịch Na2SO4 và dung dịch H2SO4.
Viết các phương trình hóa học.
Hướng dẫn giải:
a) Dung dịch HCl và dung dịch H2SO4
Lấy hai ống nghiệm nhỏ, mỗi ống chứa riêng biệt khoảng 1ml dung dịch chưa biết.
Dùng thuốc thử BaCl2, nếu chất nào tạo thành kết tủa trắng thì đó là H2SO4.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
b) Dung dịch NaCl và dung dịch Na2SO4.
Lấy hai ống nghiệm nhỏ, mỗi ống chứa riêng biệt khoảng 1ml dung dịch chưa biết.
Dùng thuốc thử BaCl2, nếu chất nào tạo thành kết tủa trắng thì đó là Na2SO4..
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
c) Dung dịch Na2SO4 và dung dịch H2SO4.
Lấy hai ống nghiệm nhỏ, mỗi ống chứa riêng biệt khoảng 1ml dung dịch chưa biết.
Dùng quỳ tím để thử, nếu quỳ tím chuyển sang màu đỏ thì đó là axit H2SO4.
Bài 4. Bảng dưới đây cho biết kết quả của 6 thí nghiệm xảy ra giữa Fe và dung dịch H2SO4 loãng.
Trong mỗi thí nghiệm người ta dùng 0,2 gam Fe tác dụng với thể tích bằng nhau của axit, nhưng có nồng độ khác nhau.
Những thí nghiệm nào chứng tỏ rằng:
a) Phản ứng xảy ra nhanh hơn khi tăng nhiệt độ?
b) Phản ứng xảy ra nhanh hơn khi tăng diện tích tiếp xúc?
c) Phản ứng xảy ra nhanh hơn khi tăng nồng độ axit?
| Thí nghiệm |
Nồng độ axit |
Nhiệt độ (°C) |
Sắt ở dạng |
Thời gian phản ứng xong (s) |
| 1 |
1M |
25 |
Lá |
190 |
| 2 |
2M |
25 |
Lá |
85 |
| 3 |
2M |
35 |
Lá |
62 |
| 4 |
2M |
50 |
Bột |
15 |
| 5 |
2M |
35 |
Bột |
45 |
| 6 |
3M |
50 |
Bột |
11 |
Hướng dẫn giải:
Khi xét ảnh hưởng của một yếu tố nào đó đến tốc độ phản ứng thì thông hường người ta cố định các yếu tố còn lại. Ví dụ khi xét ảnh hưởng của yếu tố nhiệt độ, người ta cố định các yếu tố khác như nồng độ axit, diện tích tiếp xúc.
a) Thí nghiệm 2, 5 và 4.
b) Thí nghiệm 3 và 5.
c) Thí nghiệm 4 và 6; thí nghiệm 1 và 3.
Bài 5. Hãy sử dụng những chất có sẵn: Cu, Fe, CuO, KOH, C6H12O6 (glucozơ), dung dịch H2SO4 loãng, H2SO4 đặc và những dụng cụ thí nghiệm cần thiết để làm những thí nghiệm chứng minh rằng:
a) Dung dịch H2SO4 loãng có những tính chất hóa học của axit.
b) H2SO4 đặc có những tính chất hóa học riêng.
Viết phương trình hóa học cho mỗi thí nghiệm.
Hướng dẫn giải:
a) Dung dịch H2SO4 loãng có những tính chất hóa học của axit.
2KOH + H2SO4 → K2SO4 + 2H2O
Fe+ H2SO4 → FeSO4 + H2↑
CuO + H2SO4 → CuSO4 + H2O
b) Dung dịch H2SO4 dặc ngoài những tính chất hóa học của axit còn có những tính chất hóa học riêng.
Cu+ 2H2SO4 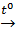 CuSO4 + SO2↑ + 2H2O
C6H12O6
CuSO4 + SO2↑ + 2H2O
C6H12O6 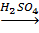 6C + 6H2O
Bài 6. Cho một khối lượng mạt sắt dư vào 50ml dung dịch HCl. Phản ứng xong, thu được 3,361ít khí (đktc).
a) Viết phương trình hóa học:
b) Tính khối lượng mạt sắt đã tham gia phản ứng;
c) Tìm nồng độ mol của dung dịch HCl đã dùng.
Hướng dẫn giải:
a) Viết phương trình hóa học:
Fe + 2HC1 → FeCl2 + H2↑
1mol 2mol 1mol
b) Tính khối lượng Fe đã phản ứng:
nFe =
6C + 6H2O
Bài 6. Cho một khối lượng mạt sắt dư vào 50ml dung dịch HCl. Phản ứng xong, thu được 3,361ít khí (đktc).
a) Viết phương trình hóa học:
b) Tính khối lượng mạt sắt đã tham gia phản ứng;
c) Tìm nồng độ mol của dung dịch HCl đã dùng.
Hướng dẫn giải:
a) Viết phương trình hóa học:
Fe + 2HC1 → FeCl2 + H2↑
1mol 2mol 1mol
b) Tính khối lượng Fe đã phản ứng:
nFe = 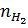 =
= 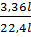 = 0,15(mol) => mFe = 0,15 x 56 = 8,4 (gam)
c) Tính CM của dung dịch HCl đã dùng
= 0,15(mol) => mFe = 0,15 x 56 = 8,4 (gam)
c) Tính CM của dung dịch HCl đã dùng
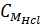 =
= 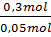 = 6 mol/lit = 6 M.
Bài 7. Hòa tan hoàn toàn 12,1 gam hỗn hợp bột CuO và ZnO cần 100ml dung dịch HCl 3M.
a) Viết các phương trình hóa học.
b) Tính phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu.
c) Hãy tính khối lượng dung dịch H2SO4 nồng độ 20% để hòa tan hoàn toàn hỗn hợp các oxit trên.
Hướng dẫn giải:
a) Viết phương trình hóa học
CuO + 2HCl → CuCl2 + H2O (1)
ZnO + 2HCl → ZnCl2 + H2O (2)
1mol 2mol
b) Tính % theo khối lượng của mỗi oxit trong hỗn hợp ban đầu. Đặt x,y là số mol của CuO và ZnO trong hỗn hợp.
Khối lượng hỗn hợp = (64 + 16) x + (65 + 16) y = 12,1 (II)
80x + 81y = 12,1
Số mol axit HCl = 2(x + y) = 0,1. 3 = 0,3 (III)
2x + 2y = 0,3 giải hệ ta được y = 0,1 mol
và x = 0,05 mol
Khối lượng CuO = 0,05.80 = 4,0 gam chiếm xấp xỉ 33%
Khối lượng ZnO = 0,1.81 = 8,1 gam chiếm xấp xỉ 67%.
c) Khối lượng axit H2SO4 20% cần dùng:
CuO + H2SO4 → CuSO4 + H2O (3)
ZnO + H2SO4 → ZnSO4 + H2O (4)
Số mol H2SO4 (3) = số mol CuO = 0,05 mol
Số mol H2SO4 (4) = số mol ZnO = 0,10 mol
Khối lượng H2SO4 = (0,10 + 0,05) 98 = 14,7 (gam)
Khối lượng dung dịch H2SO4 20% cần dùng
= 6 mol/lit = 6 M.
Bài 7. Hòa tan hoàn toàn 12,1 gam hỗn hợp bột CuO và ZnO cần 100ml dung dịch HCl 3M.
a) Viết các phương trình hóa học.
b) Tính phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu.
c) Hãy tính khối lượng dung dịch H2SO4 nồng độ 20% để hòa tan hoàn toàn hỗn hợp các oxit trên.
Hướng dẫn giải:
a) Viết phương trình hóa học
CuO + 2HCl → CuCl2 + H2O (1)
ZnO + 2HCl → ZnCl2 + H2O (2)
1mol 2mol
b) Tính % theo khối lượng của mỗi oxit trong hỗn hợp ban đầu. Đặt x,y là số mol của CuO và ZnO trong hỗn hợp.
Khối lượng hỗn hợp = (64 + 16) x + (65 + 16) y = 12,1 (II)
80x + 81y = 12,1
Số mol axit HCl = 2(x + y) = 0,1. 3 = 0,3 (III)
2x + 2y = 0,3 giải hệ ta được y = 0,1 mol
và x = 0,05 mol
Khối lượng CuO = 0,05.80 = 4,0 gam chiếm xấp xỉ 33%
Khối lượng ZnO = 0,1.81 = 8,1 gam chiếm xấp xỉ 67%.
c) Khối lượng axit H2SO4 20% cần dùng:
CuO + H2SO4 → CuSO4 + H2O (3)
ZnO + H2SO4 → ZnSO4 + H2O (4)
Số mol H2SO4 (3) = số mol CuO = 0,05 mol
Số mol H2SO4 (4) = số mol ZnO = 0,10 mol
Khối lượng H2SO4 = (0,10 + 0,05) 98 = 14,7 (gam)
Khối lượng dung dịch H2SO4 20% cần dùng
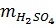 =
= 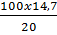 = 73,5(gam)
= 73,5(gam)
© Bản quyền thuộc về
Bài kiểm tra. Ghi rõ nguồn Bài kiểm tra.com khi sao chép nội dung này.