Tóm tắt lí thuyết Chương IV - Hóa học 8
2019-07-11T00:09:15-04:00
2019-07-11T00:09:15-04:00
Tóm tắt kiến thức cần nhớ Hóa học 8, chương IV, gồm các bài: Tính chất của oxi - Sự oxi hóa, phản ứng hóa hợp, ứng dụng của oxi - Oxit - Điều chế oxi, phản ứng phân hủy - không khí, sự cháy.
/themes/cafe/images/no_image.gif
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Thứ năm - 11/07/2019 00:08
Tóm tắt kiến thức cần nhớ Hóa học 8, chương IV, gồm các bài: Tính chất của oxi - Sự oxi hóa, phản ứng hóa hợp, ứng dụng của oxi - Oxit - Điều chế oxi, phản ứng phân hủy - không khí, sự cháy.
I. KIẾN THỨC CẦN NHỚ
1. Tính chất hoá học của oxi
- Khí oxi là một đơn chất phi kim rất hoạt động, đặc biệt ở nhiệt độ cao dễ dàng tham gia phản ứng. hoá học với nhiều chất. Oxi có thể phản ứng với phi kim, kim loại và hợp chất.
- Trong các hợp chất hoá học, nguyên tố oxi có hoá trị II (trừ các hợp chất H2O2, K2O2...).
2. Sự oxi hoá, sự cháy
- Sự tác dụng của một chất với oxi là sự oxi hoá.
- Sự oxi hoá chậm là sự tỏa nhiệt nhưng không phát sáng.
- Sự cháy là sự oxi hoá có tỏa nhiệt và phát sáng.
- Điều kiện phát sinh sự cháy là: chất phải nóng đến nhiệt độ cháy; phải đủ khí oxi cho sự cháy.
3. Phản ứng hoá hợp, phản ứng phân hủy
a) Phản ứng hoá hợp là phản ứng hoá học trong đó chỉ có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
b) Phản ứng phân hủy là phản ứng hoá học trong đó một chất sinh ra hai hay nhiều chất mới.
4. Oxit
a) Định nghĩa, cách gọi tên
Oxit là hợp chất tạo bởi hai nguyên tố, trong đó có một nguyên tố là oxi.
| Oxit: Oxi + Một nguyên tố khác |
- Công thức của oxit MxOy gồm có kí hiệu của oxi O kèm theo các chỉ số y và kí hiệu của nguyên tố khác M (có hoá trị n) kèm theo chỉ số x của nó theo đúng quy tắc về hoá trị:
II x y = n x x
- Cách gọi tên:
Tên oxit: Tên nguyên tố + oxit
Nếu: + Kim loại có nhiều hoá trị:
Tên oxit kim loại: Tên kim loại (kèm theo hoá trị) + oxit
+ Phi kim có nhiều hoá trị:
Tên oxit phi kim: Tên phi kim + oxit
(Kèm tiếp đầu ngữ (Kèm tiếp đầu ngữ
chỉ số nguyên tử) chỉ số nguyên tử)
Dùng các tiếp đầu ngữ để chỉ số nguyên tử: mono nghĩa là 1, đi là 2, tri là 3, tetra là 4, penta là 5...
b) Phân loại:
Có thể phân chia oxit thành 2 loại chính:
(1) Oxit axit: thường là oxit của phi kim tương ứng với axit.
(2) Oxit bazơ: là oxit của kim loại tương ứng với bazơ.
Lưu ý: Một số oxit kim loại, ví dụ như Mn2O7 là oxit axit (dung dịch màu xanh) và khi tan trong nước tạo dung dịch axit pemaganic HMnO4.
5. Điều chế oxi
a) Điều chế oxi trong phòng thí nghiệm
Trong phòng thí nghiệm oxi được điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân hủy ở nhiệt độ cao.
Ví dụ: 2KClO3 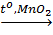 2KCl + 3O2↑
2KMnO4
2KCl + 3O2↑
2KMnO4 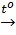 K2MnO4 MnO2 + O2↑
b) Sản xuất khí oxi trong công nghiệp
(1) Sản xuất oxi từ không khí:
K2MnO4 MnO2 + O2↑
b) Sản xuất khí oxi trong công nghiệp
(1) Sản xuất oxi từ không khí:
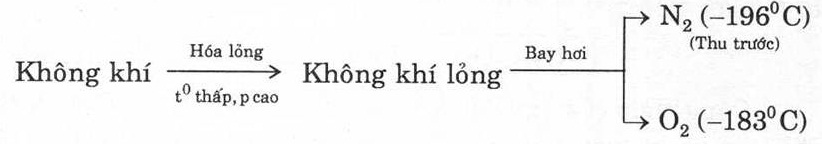 (2) Sản xuất oxi từ nước:
2H2O
(2) Sản xuất oxi từ nước:
2H2O 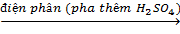 2H2 + O2↑
2H2 + O2↑
© Bản quyền thuộc về
Bài kiểm tra. Ghi rõ nguồn Bài kiểm tra.com khi sao chép nội dung này.