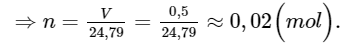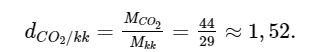Mở đầu trang 16: Bằng phép đo thông thường, ta chỉ xác định được khối lượng chất rắn, chất lỏng hoặc thể tích của chất khí. Làm thế nào để biết lượng chất có bao nhiêu phân tử, nguyên tử?
Trả lời:
Để biết được lượng chất có bao nhiêu phân tử, nguyên tử ta cần sử dụng khái niệm mol.
I. Mol
Câu hỏi 1 trang 17: Đọc thông tin Hình 3.1 và so sánh khối lượng của 1 mol nguyên tử carbon, 1 mol phân tử iodine và 1 mol phân tử nước.
Trả lời:
+ Khối lượng 1 mol nguyên tử carbon là 12 gam.
+ Khối lượng 1 mol phân tử iodine là 254 gam.
+ Khối lượng 1 mol phân tử nước là 18 gam.
Vậy khối lượng 1 mol nguyên tử carbon < khối lượng 1 mol phân tử nước < khối lượng 1 mol phân tử iodine.
Câu hỏi 2 trang 17: Tính số nguyên tử, phân tử có trong mỗi lượng chất sau:
a) 0,25 mol nguyên tử C;
b) 0,002 mol phân tử I
2;
c) 2 mol phân tử H
2O.
Trả lời:
Ta có mol là lượng chất có chứa NA (6,022 × 10
23) nguyên tử hoặc phân tử của chất đó. Vậy:
a) 0,25 mol nguyên tử C có 0,25 × 6,022 × 10
23 = 1,5055 × 10
23 nguyên tử C.
b) 0,002 mol phân tử I2 có 0,002 × 6,022 × 10
23 = 1,2044 × 10
21 phân tử I
2.
c) 2 mol phân tử H2O có 2 × 6,022 × 10
23 = 1,2044 × 1024 phân tử H
2O.
Câu hỏi 3 trang 17: Một lượng chất sau đây tương đương bao nhiêu mol nguyên tử hoặc mol phân tử?
a) 1,2044. 10
22 phân tử Fe
2O
3;
b) 7,5275. 10
24 nguyên tử Mg.
Trả lời:
Ta có mol là lượng chất có chứa NA (6,022 × 1023) nguyên tử hoặc phân tử của chất đó. Vậy:
a) 1,2044. 10
22 phân tử Fe
2O
3 tương đương với
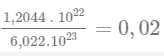
mol phân tử Fe2O3.
b) 7,5275. 1024 nguyên tử Mg tương đương với
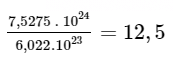
mol nguyên tử Mg.
Câu hỏi 1 trang 18: Tính khối lượng mol của chất X, biết rằng 0,4 mol chất này có khối lượng 23,4 gam.
Trả lời:
Khối lượng mol của chất X là:
Áp dụng công thức:
 Câu hỏi 2 trang 18
Câu hỏi 2 trang 18: Tính số mol phân tử có trong 9 gam nước, biết rằng khối lượng mol của nước là 18 g/ mol.
Trả lời:
Số mol phân tử có trong 9 gam nước là:
Áp dụng công thức:
 Câu hỏi 3 trang 18
Câu hỏi 3 trang 18: Calcium carbonate có công thức hóa học là CaCO
3
a) Tính khối lượng phân tử của calcium carbonate.
b) Tính khối lượng của 0,2 mol calcium carbonate.
Trả lời:
a) Khối lượng phân tử của calcium carbonate:
40 + 12 + 16 × 3 = 100 (amu).
b) Khối lượng của 0,2 mol calcium carbonate là:
Áp dụng công thức:
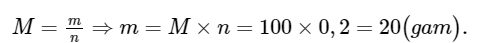 Câu hỏi 1 trang 18
Câu hỏi 1 trang 18: Ở 25
oC và 1 bar, 1,5 mol khí chiếm thể tích bao nhiêu?
Trả lời:
Ở điều kiện chuẩn (25
oC và 1 bar), 1 mol khí bất kì đều chiếm thể tích là 24,79 lít.
Vậy 1,5 mol khí ở điều kiện này chiếm thể tích V = 1,5 × 24,79 = 37,185 lít.
Câu hỏi 2 trang 18: Một hỗn hợp khí gồm 1 mol khí oxygen với 4 mol khí nitrogen. Ở 25
oC và 1 bar, hỗn hợp này có thể tích là bao nhiêu?
Trả lời:
Tổng số mol khí trong hỗn hợp là: 1 + 4 = 5 (mol).
Ở điều kiện chuẩn (25
oC và 1 bar), 1 mol khí bất kì đều chiếm thể tích là 24,79 lít.
Vậy 5 mol hỗn hợp khí ở điều kiện này chiếm thể tích:
V = 5 × 24,79 = 123,95 (lít).
Câu hỏi 3 trang 18: Tính số mol khí chứa trong bình có thể tích 500 mililít ở 25
oC và 1 bar.
Trả lời:
Ở điều kiện chuẩn (25
oC và 1 bar), 1 mol khí bất kì đều chiếm thể tích là 24,79 lít.
Đổi 500 mililít = 0,5 lít.
Số mol khí chứa trong bình có thể tích 0,5 lít ở điều kiện chuẩn là:
Áp dụng công thức: V = n × 24,79
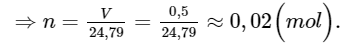 Câu hỏi 1 trang 19
Câu hỏi 1 trang 19:
a) Khí carbon dioxide (CO
2) nặng hay nhẹ hơn không khí bao nhiêu lần?
b) Trong lòng hang sâu thường xảy ra quá trình phân hủy chất vô cơ hoặc hữu cơ, sinh ra khí carbon dioxide. Hãy cho biết khí carbon dioxide tích tụ ở trên nền hang hay bị không khí đẩy bay lên trên.
Trả lời:
a) Khối lượng phân tử CO
2: 12 + 16 . 2 = 44 (amu).
Tỉ khối của khí carbon dioxide so với không khí:
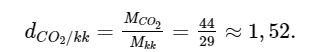
Vậy khí carbon dioxide nặng hơn không khí khoảng 1,52 lần.
b) Trong lòng hang sâu thường xảy ra quá trình phân hủy chất vô cơ hoặc hữu cơ, sinh ra khí carbon dioxide. Do nặng hơn không khí khoảng 1,52 lần nên khí carbon dioxide tích tụ ở trên nền hang.
Câu hỏi 2 trang 19:
a) Khí methane (CH
4) nặng hơn hay nhẹ hơn không khí bao nhiêu lần?
b) Dưới đáy giếng thường xảy ra quá trình phân huỷ chất hữu cơ, sinh ra khí methane. Hãy cho biết khí methane tích tụ dưới đáy giếng hay bị không khí đẩy bay lên trên.
Trả lời:
a) Khối lượng phân tử khí methane: 12 + 4 . 1 = 16 (amu).
Tỉ khối của khí methane so với không khí:

Vậy khí methane nhẹ hơn không khí khoảng 0,55 lần.
b) Dưới đáy giếng thường xảy ra quá trình phân huỷ chất hữu cơ, sinh ra khí methane. Do nhẹ hơn không khí nên khí methane sẽ
không tích tụ dưới đáy giếng mà bị không khí đẩy bay lên trên.
Em có thể trang 19 KHTN 8: Cảnh báo nguy cơ mất an toàn khi nạo, vét giếng, thám hiểm hang, động ….
Trả lời:
Các giếng nước hay hang động, hầm lò sâu… thường có nhiều khí độc tích tụ như CO
2; H
2S… Hàng năm, nước ta có rất nhiều vụ tử vong thương tâm do ngạt khí khi nạo vét giếng… Do vậy, đối với những giếng nước, hang động, hầm lò sâu chúng ta luôn phải cảnh giác, trước khi đưa người xuống cần phải thăm dò xem không khí dưới đó có thở được không.
Ví dụ một số cách thử trước khi xuống nạo, vét giếng như:
+ Thắp một ngọn nến, dòng dây thả dần sát xuống mặt nước nếu ngọn nến vẫn cháy sáng bình thường là không khí dưới đáy giếng có đủ oxygen, người có thể xuống được. Nếu ngọn nến chỉ cháy leo lét rồi tắt thì không nên xuống vì dưới đó thiếu oxygen hoặc phải trang bị bình dưỡng khí trước khi xuống.
+ Nhốt một con vật vào lồng, buộc dây thả gần sát mặt giếng, nếu con vật bị chết ngạt chứng tỏ không khí dưới đáy giếng thiếu oxygen …
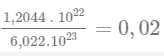 mol phân tử Fe2O3.
mol phân tử Fe2O3.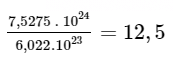 mol nguyên tử Mg.
mol nguyên tử Mg.