Phương pháp giải Hóa 8, Dạng toán: Tính toán dựa vào phản ứng phân hủy
2020-02-05T20:41:31-05:00
2020-02-05T20:41:31-05:00
Hướng dẫn giải Hóa 8, Dạng toán: Tính toán dựa vào phản ứng phân hủy
https://baikiemtra.com/uploads/news/2020_02/phuong-phap-giai-hoa-hoc-8.jpg
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Thứ tư - 05/02/2020 20:39
Hướng dẫn giải Hóa 8, Dạng toán: Tính toán dựa vào phản ứng phân hủy
Bài tập mẫu:
Bài 1. Tính số mol và số gam kali clorat cần thiết để điều chế được:
a) 48 gam khí oxi
b) 44,8 lít khí oxi (ở đktc).
Giải
Phương trình hóa học:
2KClO3 –(t0)-> 2KCl + 3O2 ↑
a) Ta có: 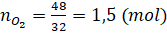 Theo phương trình hóa học:
2 mol KClO3 tham gia phản ứng sinh ra 3 mol O2
=> 1 mol KClO3 tham gia phản ứng sinh ra 1,5 mol O2
Khối lượng của KClO3 là:
mKClO3 = nKClO3 x MKClO3 = 1 x (39 + 35,5 + 3x16) = 122,5 (gam).
b) Ta có:
Theo phương trình hóa học:
2 mol KClO3 tham gia phản ứng sinh ra 3 mol O2
=> 1 mol KClO3 tham gia phản ứng sinh ra 1,5 mol O2
Khối lượng của KClO3 là:
mKClO3 = nKClO3 x MKClO3 = 1 x (39 + 35,5 + 3x16) = 122,5 (gam).
b) Ta có: 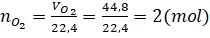 Theo phương trình hóa học:
2 mol KClO3 tham gia phản ứng sinh ra 3 mol O2
=>
Theo phương trình hóa học:
2 mol KClO3 tham gia phản ứng sinh ra 3 mol O2
=>  mol KClO3 tham gia phản ứng sinh ra 2 mol O2
Khối lượng của KCIO3 là:
mKClO3 = nKClO3 x MKClO3 =
mol KClO3 tham gia phản ứng sinh ra 2 mol O2
Khối lượng của KCIO3 là:
mKClO3 = nKClO3 x MKClO3 =  x 122,5 ≈ 163,3 (gam)
Bài 2. Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng oxi để oxi hóa sắt ở nhiệt độ cao.
a) Tính số gam sắt và số gam khí oxi cần dùng để điều chế được 2,32 gam oxit sắt từ.
b) Tính số gam kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên.
Giải
a) Phương trình hóa học:
3Fe + 2O2 –(t0)-> Fe3O4
Ta có:
x 122,5 ≈ 163,3 (gam)
Bài 2. Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng oxi để oxi hóa sắt ở nhiệt độ cao.
a) Tính số gam sắt và số gam khí oxi cần dùng để điều chế được 2,32 gam oxit sắt từ.
b) Tính số gam kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên.
Giải
a) Phương trình hóa học:
3Fe + 2O2 –(t0)-> Fe3O4
Ta có: 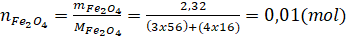 Theo phương trình phản ứng:
3 mol Fe tham gia phản ứng cùng 2 mol O2 sinh ra 1 mol Fe3O4.
0,03 mol Fe tham gia phản ứng cùng 0,02 mol O2 sinh ra 0,01 mol Fe3O4.
Vậy: mFe = nFe x MFe = 0,03 x 56 = 1,68 (gam)
mO2 = nO2 x MO2= 0,02 x 32 = 0,64 (gam).
b) Phương trình hóa học:
2KMnO4 –(t0)-> K2MnO4 + MnO2 + O2↑
Theo phương trình hóa học:
2 mol KMnO4 tham gia phản ứng sinh ra 1 mol O2.
0,01 mol KMnO4 tham gia phản ứng sinh ra 0,02 mol O2.
Khối lượng KMnO4:
mKMnO4 = nKMnO4 x MKMnO4= 0,04 x (39 + 55 + 4x16) = 6,32 (gam).
Theo phương trình phản ứng:
3 mol Fe tham gia phản ứng cùng 2 mol O2 sinh ra 1 mol Fe3O4.
0,03 mol Fe tham gia phản ứng cùng 0,02 mol O2 sinh ra 0,01 mol Fe3O4.
Vậy: mFe = nFe x MFe = 0,03 x 56 = 1,68 (gam)
mO2 = nO2 x MO2= 0,02 x 32 = 0,64 (gam).
b) Phương trình hóa học:
2KMnO4 –(t0)-> K2MnO4 + MnO2 + O2↑
Theo phương trình hóa học:
2 mol KMnO4 tham gia phản ứng sinh ra 1 mol O2.
0,01 mol KMnO4 tham gia phản ứng sinh ra 0,02 mol O2.
Khối lượng KMnO4:
mKMnO4 = nKMnO4 x MKMnO4= 0,04 x (39 + 55 + 4x16) = 6,32 (gam).