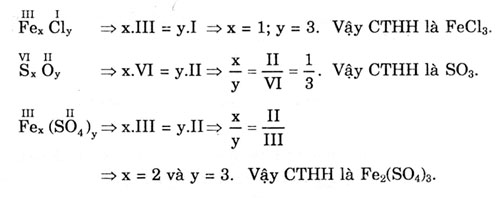Tóm tắt lí thuyết Chương I - Hóa học 8
2019-07-06T05:49:11-04:00
2019-07-06T05:49:11-04:00
Tóm tắt kiến thức cần nhớ Hóa học 8, chương I, gồm các bài: Chất - Nguyên tử - Phân tử - Đơn vị đo khối lượng nguyên tử, phân tử - Nguyên tố hoá học - Đơn chất, hợp chất - Hoá trị
/themes/cafe/images/no_image.gif
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Thứ bảy - 06/07/2019 04:18
Tóm tắt kiến thức cần nhớ Hóa học 8, chương I, gồm các bài: Chất - Nguyên tử - Phân tử - Đơn vị đo khối lượng nguyên tử, phân tử - Nguyên tố hoá học - Đơn chất, hợp chất - Hoá trị
I. KIẾN THỨC CẦN NHỚ
1. Chất
- Chất có ở khắp nơi, đâu có vật thể nơi đó có chất. Mỗi chất có những tính chất vật lí và hoá học.
- Dựa vào sự khác nhau về tính chất (vật lí và hoá học) để tách một chất ra khỏi hỗn hợp.
- Chất tinh khiết là chất chỉ gồm một loại phân tử.
2. Nguyên tử
- Nguyên tử là hạt vô cùng nhỏ, trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi những electron mang điện tích âm.
- Trong hạt nhân có bao nhiêu proton thì trong nguyên tử có bấy nhiêu electron.
Số p = số e
- Hạt nhân nguyên tử tạo bởi proton và nơtron.
- Proton và nơtron có cùng khối lượng, còn electron có khối lượng rất bé, không đáng kể. Vì vậy khối lượng của hạt nhân được coi là khối lượng của nguyên tử.
3. Phân tử
- Phân tử là hạt đại diện cho chất, gồm một số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hoá học của chất.
- Trong các phân tử hoá học, liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác.
4. Đơn vị đo khối lượng nguyên tử, phân tử
a) Đơn vị đo khối lượng nguyên tử
- Nguyên tử khối (NTK) cho biết độ nặng nhẹ khác nhau giữa các Những nguyên tố kim loại như Na, Cu, Zn, Fe... là phân tử đơn nguyên tử.
nguyên tử và là đại lượng đặc trưng cho từng nguyên tử của mỗi nguyên tố.
- Số đo khối lượng nguyên tử tính bằng đơn vị cacbon (đvC) gọi là nguyên tử khối.
- Cách tính nguyên tử khối. Nguyên tử khối là con số so sánh khối lượng của nguyên tử với 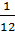 khối lượng nguyên tử cacbon.
khối lượng nguyên tử cacbon.
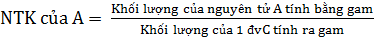
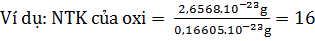 (
( 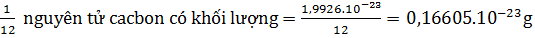 )
Kích thước của nguyên tử: Nói chung các nguyên tử có đường kính d ≈ 108cm.
b) Phân tử khối
- Phân tử khối (PTK) là khối lượng của một phân tử tính bằng đơn vị cacbon.
- Cách tính phân tử khối: Là tổng số nguyên tử khối của các nguyên tử tạo thành phân tử.
Ví dụ: Tính PTK của axit sunfuric H2SO4.
H2SO4 = (1 x 2) + 32 + (16 x 4) = 98 đvC
5. Nguyên tố hoá học
- Nguyên tố hoá học là tập hợp những nguyên tử cùng loại, có cùng số proton trong hạt nhân.
- Mọi nguyên tố hoá học được biểu diễn ngắn gọn bằng một kí hiệu hoá học.
6. Đơn chất, hợp chất
a) Đơn chất là những chất tạo nên từ một nguyên tố hoá học.
- Phân tử do một hay nhiều nguyên tử của một nguyên tố hoá học cấu tạo nên.
- Phân tử chỉ có một nguyên tử kim loại (K, Cu); một số phi kim (C, S).
- Phân tử gồm hai nguyên tử cùng loại trở lên. Phần lớn là phi kim (Na, H2, O2, O3...)
b) Hợp chất
- Hợp chất là những chất tạo nên từ hai nguyên tố hoá học trở lên.
- Phân tử được tạo thành từ hai nguyên tố hoá học trở lên, hay là phân tử gồm từ hai nguyên tử khác loại trở lên (H2O, HCl, Na2SO4, NaCl. ).
7. Hoá trị
Hoá trị của nguyên tố (hay nhóm nguyên tử) là con số biểu thị khả năng liên kết của nguyên tử (hay nhóm nguyên tử) này với một số nhất định nguyên tử (hay nhóm nguyên tử) khác.
- Hoá trị của một nguyên tố trong hợp chất được quy định:
• Hoá trị của nguyên tố H bằng I. Từ đó suy ra hoá trị của nguyên tố khác.
Ví dụ: Theo công thức AHy, hoá trị của A bằng y.
HC1 (C1 hoá trị I); H2O (oxi hoá trị II); CH4 (cacbon hoá trị IV).
• Hoá trị còn được xác định gián tiếp qua nguyên tố oxi, hoá trị của oxi được xác định bằng II.
Ví dụ: Trong phân tử BOy, hoá trị của B bằng 2y. B2Oy hoá trị của B bằng y (trừ B là hiđro) như SO3 hoá trị của S bằng VI, Na2O hoá trị của Na bằng I, Al2O3 hoá trị của Al bằng III.
- Trong hợp chất hai nguyên tố AxBy:
Ta dựa vào quy tắc “Tích của chỉ số với hoá trị của nguyên tố này, bằng tích của chỉ số với hoá trị của nguyên tố kia”: x.a = y.b (a là hoá trị của A, b là hoá trị của B; B có thể là nhóm nguyên tử).
• Nếu a = b:
)
Kích thước của nguyên tử: Nói chung các nguyên tử có đường kính d ≈ 108cm.
b) Phân tử khối
- Phân tử khối (PTK) là khối lượng của một phân tử tính bằng đơn vị cacbon.
- Cách tính phân tử khối: Là tổng số nguyên tử khối của các nguyên tử tạo thành phân tử.
Ví dụ: Tính PTK của axit sunfuric H2SO4.
H2SO4 = (1 x 2) + 32 + (16 x 4) = 98 đvC
5. Nguyên tố hoá học
- Nguyên tố hoá học là tập hợp những nguyên tử cùng loại, có cùng số proton trong hạt nhân.
- Mọi nguyên tố hoá học được biểu diễn ngắn gọn bằng một kí hiệu hoá học.
6. Đơn chất, hợp chất
a) Đơn chất là những chất tạo nên từ một nguyên tố hoá học.
- Phân tử do một hay nhiều nguyên tử của một nguyên tố hoá học cấu tạo nên.
- Phân tử chỉ có một nguyên tử kim loại (K, Cu); một số phi kim (C, S).
- Phân tử gồm hai nguyên tử cùng loại trở lên. Phần lớn là phi kim (Na, H2, O2, O3...)
b) Hợp chất
- Hợp chất là những chất tạo nên từ hai nguyên tố hoá học trở lên.
- Phân tử được tạo thành từ hai nguyên tố hoá học trở lên, hay là phân tử gồm từ hai nguyên tử khác loại trở lên (H2O, HCl, Na2SO4, NaCl. ).
7. Hoá trị
Hoá trị của nguyên tố (hay nhóm nguyên tử) là con số biểu thị khả năng liên kết của nguyên tử (hay nhóm nguyên tử) này với một số nhất định nguyên tử (hay nhóm nguyên tử) khác.
- Hoá trị của một nguyên tố trong hợp chất được quy định:
• Hoá trị của nguyên tố H bằng I. Từ đó suy ra hoá trị của nguyên tố khác.
Ví dụ: Theo công thức AHy, hoá trị của A bằng y.
HC1 (C1 hoá trị I); H2O (oxi hoá trị II); CH4 (cacbon hoá trị IV).
• Hoá trị còn được xác định gián tiếp qua nguyên tố oxi, hoá trị của oxi được xác định bằng II.
Ví dụ: Trong phân tử BOy, hoá trị của B bằng 2y. B2Oy hoá trị của B bằng y (trừ B là hiđro) như SO3 hoá trị của S bằng VI, Na2O hoá trị của Na bằng I, Al2O3 hoá trị của Al bằng III.
- Trong hợp chất hai nguyên tố AxBy:
Ta dựa vào quy tắc “Tích của chỉ số với hoá trị của nguyên tố này, bằng tích của chỉ số với hoá trị của nguyên tố kia”: x.a = y.b (a là hoá trị của A, b là hoá trị của B; B có thể là nhóm nguyên tử).
• Nếu a = b: 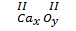 x.II = y.II => x = y
Vậy công thức hoá học là CaO.
• Nếu a = b:
x.II = y.II => x = y
Vậy công thức hoá học là CaO.
• Nếu a = b: 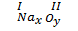 x.I = y.II => x = 2 và y = 1
Vậy công thức hoá học là Na2O.
II. HƯỚNG DẪN LẬP CÔNG THỨC HOÁ HỌC
- Công thức hoá học dùng biểu diễn chất, gồm một kí hiệu hoá học (đơn chất) hay hai, ba... kí hiệu hoá học (hợp chất) và chỉ số ở chân mỗi kí hiệu.
- Mỗi công thức hoá học chỉ một phân tử của chất (trừ đơn chất kim loại...), cho biết nguyên tố tạo ra chất, số nguyên tử mỗi nguyên tố và phân tử khối.
- Lập công thức hoá học của hợp chất theo hoá trị:
Lập công thức dạng
x.I = y.II => x = 2 và y = 1
Vậy công thức hoá học là Na2O.
II. HƯỚNG DẪN LẬP CÔNG THỨC HOÁ HỌC
- Công thức hoá học dùng biểu diễn chất, gồm một kí hiệu hoá học (đơn chất) hay hai, ba... kí hiệu hoá học (hợp chất) và chỉ số ở chân mỗi kí hiệu.
- Mỗi công thức hoá học chỉ một phân tử của chất (trừ đơn chất kim loại...), cho biết nguyên tố tạo ra chất, số nguyên tử mỗi nguyên tố và phân tử khối.
- Lập công thức hoá học của hợp chất theo hoá trị:
Lập công thức dạng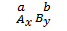 . Khi biết hoá trị của nguyên tố A là a, của B là b, lập tỉ lệ
. Khi biết hoá trị của nguyên tố A là a, của B là b, lập tỉ lệ 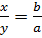 và nhẩm tính theo ba trường hợp sau:
a) Khi a = b thì x = y = 1.
Ví dụ:
và nhẩm tính theo ba trường hợp sau:
a) Khi a = b thì x = y = 1.
Ví dụ: 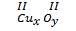 → x = y = 1 → CuO.
b) Khi a = 1 thì x = b và y = 1 hoặc b = 1 thì x = 1 và y = a.
Ví dụ:
→ x = y = 1 → CuO.
b) Khi a = 1 thì x = b và y = 1 hoặc b = 1 thì x = 1 và y = a.
Ví dụ: 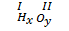 → x = b, y = 1 → H2O.
c) Khi a ≠ b và đều ≥ 2 thì x = b và y = a.
Nếu cả x và y đều là só chẵn, hoặc có ước số chung, thì rút gọn lấy số đơn giản nhất.
→ x = b, y = 1 → H2O.
c) Khi a ≠ b và đều ≥ 2 thì x = b và y = a.
Nếu cả x và y đều là só chẵn, hoặc có ước số chung, thì rút gọn lấy số đơn giản nhất.