Tóm tắt lí thuyết Chương II - Hóa học 8
2019-07-08T22:52:51-04:00
2019-07-08T22:52:51-04:00
Tóm tắt kiến thức cần nhớ Hóa học 8, chương II, gồm các bài: Sự biến đổi chất - Phản ứng hóa học - Định luật bảo toàn khối lượng - Phương trình hóa học.
/themes/cafe/images/no_image.gif
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Thứ hai - 08/07/2019 22:49
Tóm tắt kiến thức cần nhớ Hóa học 8, chương II, gồm các bài: Sự biến đổi chất - Phản ứng hóa học - Định luật bảo toàn khối lượng - Phương trình hóa học.
I. KIẾN THỨC CẨN NHỚ
1. Sự biến đổi chất
- Hiện tượng hoá học là hiện tượng khi có sự biến đổi chất này thành chất khác.
- Hiện tượng vật lí là hiện tượng khi chất biến đổi về trạng thái hay hình dạng mà vẫn giữ nguyên chất ban đầu.
2. Phản ứng hoá học
- Phản ứng hoá học là quá trình làm biến đổi chất này thành chất khác.
- Trong phản ứng hoá học chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác.
3. Định luật bảo toàn khối lượng
“Trong một phản ứng hoá học, tổng khối lượng của các sản phẩm bằng tổng khối lượng của chất tham gia phản ứng”.
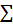 mcủa các sản phẩm =
mcủa các sản phẩm = 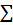 mcủa các chất tham gia
4. Phương trình hoá học
- Phương trình hoá học biểu diễn ngắn gọn các chất tham gia và chất tạo thành trong một phản ứng hoá học.
- Phương trình hoá học cho biết tỉ lệ về số phân tử giữa chất tham gia và chất tạo thành cũng như từng cặp chất trong phản ứng.
Lưu ý: Một số trường hợp phân tử là đơn nguyên tử, ví dụ như các nguyên tố kim loại.
II. HƯỚNG DẪN LẬP PHƯƠNG TRÌNH HOÁ HỌC
Khi lập phương trình hoá học cần lưu ý:
1. Viết đúng công thức hoá học của các chất tham gia và chất tạo thành.
2. Chọn hệ số phương trình sao cho số nguyên tử của mỗi nguyên tố ở hai vế đều bằng nhau. Cách làm như sau:
Nên bắt đầu từ những nguyên tố mà số nguyên tử có nhiều và không bằng nhau.
+ Trường hợp số nguyên tử của một nguyên tố ở vế này là số chẵn và ở vế kia là số lẻ thì trước hết phải đặt hệ số 2 cho chất mà số nguyên tử là số lẻ, rồi tiếp tục đặt hệ số cho phân tử chứa số nguyên tử chẵn ở vế còn lại sao cho số nguyên tử của nguyên tố này ở hai vế bằng nhau.
Ví dụ 1: Lập phương trình hoá học của phản ứng có sơ đồ sau:
Fe + O2 → Fe2O3
Bước 1: Đặt hệ số 2 trước công thức Fe2O3, như vậy số nguyên tử oxi ở vế trái là 6 nguyên tử, nên hệ số của phân tử oxi là 3.
Bước 2: Cân bằng số nguyên tử Fe để hai vế của phương trình là bằng nhau. Phương trình sau khi cân bằng như sau:
4Fe + 3O2 → 2Fe2O3
+ Trong trường hợp phân tử có 3 loại nguyên tố thì thường số nguyên tử của 2 loại nguyên tố kết hợp thành một nhóm nguyên tử, ta coi cả nhóm tương đương với một nguyên tố.
Ví dụ 2: Lập phương trình hoá học của phản ứng có sơ đồ sau:
Al + H2SO4 → Al2(SO4)3 + H2
Nhóm SO4 tương đương như một nguyên tố.
Vậy nhóm SO4 có nhiều nhất và lại không bằng nhau ở hai vế, nên ta cân bằng trước, đặt hệ số 3 trước phân tử H2SO4, sau đó cân bằng số nguyên tử H và sau cùng là số nguyên tử Al. Phương trình sau khi cân bằng như sau:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Trong quá trình cân bằng không được thay đổi các chỉ số nguyên tử trong các công thức hoá học.
mcủa các chất tham gia
4. Phương trình hoá học
- Phương trình hoá học biểu diễn ngắn gọn các chất tham gia và chất tạo thành trong một phản ứng hoá học.
- Phương trình hoá học cho biết tỉ lệ về số phân tử giữa chất tham gia và chất tạo thành cũng như từng cặp chất trong phản ứng.
Lưu ý: Một số trường hợp phân tử là đơn nguyên tử, ví dụ như các nguyên tố kim loại.
II. HƯỚNG DẪN LẬP PHƯƠNG TRÌNH HOÁ HỌC
Khi lập phương trình hoá học cần lưu ý:
1. Viết đúng công thức hoá học của các chất tham gia và chất tạo thành.
2. Chọn hệ số phương trình sao cho số nguyên tử của mỗi nguyên tố ở hai vế đều bằng nhau. Cách làm như sau:
Nên bắt đầu từ những nguyên tố mà số nguyên tử có nhiều và không bằng nhau.
+ Trường hợp số nguyên tử của một nguyên tố ở vế này là số chẵn và ở vế kia là số lẻ thì trước hết phải đặt hệ số 2 cho chất mà số nguyên tử là số lẻ, rồi tiếp tục đặt hệ số cho phân tử chứa số nguyên tử chẵn ở vế còn lại sao cho số nguyên tử của nguyên tố này ở hai vế bằng nhau.
Ví dụ 1: Lập phương trình hoá học của phản ứng có sơ đồ sau:
Fe + O2 → Fe2O3
Bước 1: Đặt hệ số 2 trước công thức Fe2O3, như vậy số nguyên tử oxi ở vế trái là 6 nguyên tử, nên hệ số của phân tử oxi là 3.
Bước 2: Cân bằng số nguyên tử Fe để hai vế của phương trình là bằng nhau. Phương trình sau khi cân bằng như sau:
4Fe + 3O2 → 2Fe2O3
+ Trong trường hợp phân tử có 3 loại nguyên tố thì thường số nguyên tử của 2 loại nguyên tố kết hợp thành một nhóm nguyên tử, ta coi cả nhóm tương đương với một nguyên tố.
Ví dụ 2: Lập phương trình hoá học của phản ứng có sơ đồ sau:
Al + H2SO4 → Al2(SO4)3 + H2
Nhóm SO4 tương đương như một nguyên tố.
Vậy nhóm SO4 có nhiều nhất và lại không bằng nhau ở hai vế, nên ta cân bằng trước, đặt hệ số 3 trước phân tử H2SO4, sau đó cân bằng số nguyên tử H và sau cùng là số nguyên tử Al. Phương trình sau khi cân bằng như sau:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Trong quá trình cân bằng không được thay đổi các chỉ số nguyên tử trong các công thức hoá học.
© Bản quyền thuộc về
Bài kiểm tra. Ghi rõ nguồn Bài kiểm tra.com khi sao chép nội dung này.