Giải bài tập Hóa học 9, Bài 7: Tính chất hóa học của Bazơ
2019-06-28T00:15:18-04:00
2019-06-28T00:15:18-04:00
Giải bài tập Hóa học 9, Bài 7: Tính chất hóa học của Bazơ
/themes/cafe/images/no_image.gif
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Thứ sáu - 28/06/2019 00:15
Giải bài tập Hóa học 9, Bài 7: Tính chất hóa học của Bazơ
Bài 1. Có phải tất cả các chất kiềm đều là bazơ không? Dẫn ra công thức hóa học của vài ba chất kiềm. Có phải tất cả các bazơ đều là chất kiềm không? Dẫn ra công thức hóa học của những bazơ để minh họa.
Hướng dẫn giải:
Bazơ chia làm hai loại, bazơ tan trong nước thành dung dịch gọi là kiềm và bazơ không tan.
Bazơ kiềm như: NaOH, KOH, Ca(OH)2, Ba(OH)2...
Bazơ không tan như: Fe(OH)2, Fe(OH)3, Cu(OH)2, ...
Bài 2. Có những bazơ sau: Cu(OH)2, NaOH, Ba(OH)2. Hãy cho biết những bazơ nào:
a) Tác dụng được với dung dịch HCl?
b) Bị nhiệt phân hủy?
c) Tác dụng được với CO2?
d) Đổi màu quỳ tím thành xanh?
Viết các phương trình hóa học
Hướng dẫn giải:
a) Tất cả các bazơ đều tác dụng với axit clohiđric.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
NaOH + HCl → NaCl + H2O
b) Bị nhiệt phân hủy chỉ gồm các bazơ không tan.
Cu(OH)2 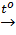 CuO + H2O
c) Tác dụng được với CO2 chỉ gồm các kiềm.
Ba(OH)2 + CO2 → BaCO3 + H2O
2NaOH + CO2 → Na2CO3 + H2O
d) Đổi màu quỳ tím thành xanh là tính chất riêng của kiềm: Ba(OH)2 và NaOH.
Bài 3. Từ những chất có sẵn là Na2O, CaO, H2O và các dung địch CuCl2, FeCl3. Hãy viết các phương trình hóa học điều chế:
a) Các dung dịch bazơ; b) Các bazơ không tan.
Hướng dẫn giải:
a) Điều chế các dung dịch bazơ.
Na2O+H2O →2NaOH
CaO + H2O → Ca(OH)2
Nhận xét: Điều chế kiềm từ oxit bazơ tương ứng.
b) Điều chế các bazơ không tan.
CuCl2 + 2NaOH → 2NaCl+ Cu(OH)2↓
FeCl3 + 3NaOH → 3NaCl+ Fe(OH)3↓
Nhận xét: Điều chế bazơ không tan từ muối tương ứng tác dụng với kiềm.
Bài 4. Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: NaCl, Ba(OH)2, NaOH và Na2SO4. Chỉ được dùng quỳ tím, làm thế nào nhận biết dung dịch đựng trong mỗi lọ bằng phương trình hóa học? Viết các phương trình hóa học.
Hướng dẫn giải:
Nhận biết các lọ không nhãn: NaCl, Ba(OH)2, NaOH và Na2SO4. Lấy 4 ống nghiệm, lấy mỗi chất vào từng ống nghiệm, đánh số thứ tự các ống và thử theo các bước sau:
Bước 1: Nhỏ dung dịch của 4 chất trên vào một mẩu quỳ tím. Nếu quỳ hóa xanh thì đó là các kiếm: Ba(OH)2 và NaOH. Nếu quỳ không đổi màu thì đó là NaCl và Na2SO4.
Bước 2. Lấy 2 dung dịch kiềm đổ ỉần lượt vào 2 lọ còn lại, nếu thấy xuất hiện kết tủa thì đó là dung dịch Ba(OH)2 và Na2SO4:
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH
Bước 3. Nhận biết được dung dịch kiềm còn lại là NaOH và muối còn lại là NaCl.
Bài 5. Cho 15,5 gara natri oxit Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
a) Viết phương trình hóa học và tính nồng độ mol của dung dịch bazơ thu đuợc.
b) Tính thể tích dung dịch H2SO4 20% có khối lượng riêng l,14g/ml cần dùng để trung hòa dung dịch bazơ nói trên.
Hướng dẫn giải:
a) Viết phương trình hóa học và tính nồng độ M của dung dịch NaOH.
Na2O+ H2O → 2NaOH
CuO + H2O
c) Tác dụng được với CO2 chỉ gồm các kiềm.
Ba(OH)2 + CO2 → BaCO3 + H2O
2NaOH + CO2 → Na2CO3 + H2O
d) Đổi màu quỳ tím thành xanh là tính chất riêng của kiềm: Ba(OH)2 và NaOH.
Bài 3. Từ những chất có sẵn là Na2O, CaO, H2O và các dung địch CuCl2, FeCl3. Hãy viết các phương trình hóa học điều chế:
a) Các dung dịch bazơ; b) Các bazơ không tan.
Hướng dẫn giải:
a) Điều chế các dung dịch bazơ.
Na2O+H2O →2NaOH
CaO + H2O → Ca(OH)2
Nhận xét: Điều chế kiềm từ oxit bazơ tương ứng.
b) Điều chế các bazơ không tan.
CuCl2 + 2NaOH → 2NaCl+ Cu(OH)2↓
FeCl3 + 3NaOH → 3NaCl+ Fe(OH)3↓
Nhận xét: Điều chế bazơ không tan từ muối tương ứng tác dụng với kiềm.
Bài 4. Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: NaCl, Ba(OH)2, NaOH và Na2SO4. Chỉ được dùng quỳ tím, làm thế nào nhận biết dung dịch đựng trong mỗi lọ bằng phương trình hóa học? Viết các phương trình hóa học.
Hướng dẫn giải:
Nhận biết các lọ không nhãn: NaCl, Ba(OH)2, NaOH và Na2SO4. Lấy 4 ống nghiệm, lấy mỗi chất vào từng ống nghiệm, đánh số thứ tự các ống và thử theo các bước sau:
Bước 1: Nhỏ dung dịch của 4 chất trên vào một mẩu quỳ tím. Nếu quỳ hóa xanh thì đó là các kiếm: Ba(OH)2 và NaOH. Nếu quỳ không đổi màu thì đó là NaCl và Na2SO4.
Bước 2. Lấy 2 dung dịch kiềm đổ ỉần lượt vào 2 lọ còn lại, nếu thấy xuất hiện kết tủa thì đó là dung dịch Ba(OH)2 và Na2SO4:
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH
Bước 3. Nhận biết được dung dịch kiềm còn lại là NaOH và muối còn lại là NaCl.
Bài 5. Cho 15,5 gara natri oxit Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
a) Viết phương trình hóa học và tính nồng độ mol của dung dịch bazơ thu đuợc.
b) Tính thể tích dung dịch H2SO4 20% có khối lượng riêng l,14g/ml cần dùng để trung hòa dung dịch bazơ nói trên.
Hướng dẫn giải:
a) Viết phương trình hóa học và tính nồng độ M của dung dịch NaOH.
Na2O+ H2O → 2NaOH
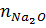 = 15,5 : (46 + 16) = 0,25(mol). nNaOH = 2 x 0,25 = 0,5 mol.
= 15,5 : (46 + 16) = 0,25(mol). nNaOH = 2 x 0,25 = 0,5 mol.
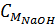 = 0,5:0,5 = 1 M.
b) Tính thể tích dung dịch H2SO4 20% có d = 1,14g/ml cần để trung hòa dung dịch trên.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
1 mol 2 mol
xmol 0,5 mol ⇒ x = 0,5 : 2 = 0,25 (mol)
Khối lượng H2SO4 là 0,25 . 98 = 24,5 (gam).
Khối lượng dung dịch H2SO4 20% là
= 0,5:0,5 = 1 M.
b) Tính thể tích dung dịch H2SO4 20% có d = 1,14g/ml cần để trung hòa dung dịch trên.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
1 mol 2 mol
xmol 0,5 mol ⇒ x = 0,5 : 2 = 0,25 (mol)
Khối lượng H2SO4 là 0,25 . 98 = 24,5 (gam).
Khối lượng dung dịch H2SO4 20% là 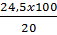 = 122,5(gam).
Thể tích dung dịch H2SO4 20% là
= 122,5(gam).
Thể tích dung dịch H2SO4 20% là 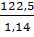 = 107,5(ml)
= 107,5(ml)
© Bản quyền thuộc về
Bài kiểm tra. Ghi rõ nguồn Bài kiểm tra.com khi sao chép nội dung này.