Giải bài tập Hóa học 9, Bài 8: Một số Bazơ quan trọng
2019-06-28T03:47:48-04:00
2019-06-28T03:47:48-04:00
Giải bài tập Hóa học 9, Bài 8: Một số Bazơ quan trọng
/themes/cafe/images/no_image.gif
Bài Kiểm Tra
https://baikiemtra.com/uploads/bai-kiem-tra-logo.png
Thứ sáu - 28/06/2019 03:45
Giải bài tập Hóa học 9, Bài 8: Một số Bazơ quan trọng
A. Natri hiđroxit
Bài 1. Có 3 lọ không nhãn, mỗi lọ đựng một chất rắn sau: NaOH, Ba(OH)2, NaCl. Hãy trình bày cách nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học (nếu có).
Hướng dẫn giải:
Bước 1: Lấy mỗi hóa chất một ít ra một ống nghiệm, thêm 1ml nước cất cho tan hết chất rắn, đánh số thứ tự 1, 2, 3. Thêm 1 giọt cung dịch phenolphtalein vào mỗi ống nghiệm. Nếu ống nghiện nào có màu đỏ thì đó là NaOH và Ba(OH)2, ống nghiệm không có hiện tượng gì xảy ra thì đó là NaCl.
Bước 2: Phân biệt NaOH và Ba(OH)2 nhờ muối Na2SO4. Nếu xuất hiện kết tủa trắng thì đó là Ba(OH)2, nếu không có hiện tượng gì thì đó là NaOH.
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH |
|
Bài 2. Trong phòng thí nghiệm có những chất sau: vôi sống CaO, sô đa Na2CO3 và nước H2O. Từ những chất đã có, hãy viết các phương trình hóa học điều chế NaOH.
Hướng dẫn giải:
Cho vôi sống tác dụng với nước:
CaO + H2O → Ca(OH)2
Lọc lấy dung dịch Ca(OH)2, cho tác dụng với sôđa.
Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
Bài 3. Có những chất sau: Zn, Zn(OH)2, NaOH, Fe(OH)3, CuSO4, NaCl, HCl. Hãy chọn những chất thích hợp điền vào mỗi sơ đồ phản ứng sau và lập phương trình hóa học:
a) ……  Fe2O3 + H2O;
b) H2SO4 + ….. → Na2SO4 + H2O;
c) H2SO4 + ….. → ZnSO4 + H2O;
d) NaOH +…... → NaCl + H2O;
e) ..... + CO2 → Na2CO3 + H2O.
Hướng dẫn giải:
a) 2Fe(OH)3
Fe2O3 + H2O;
b) H2SO4 + ….. → Na2SO4 + H2O;
c) H2SO4 + ….. → ZnSO4 + H2O;
d) NaOH +…... → NaCl + H2O;
e) ..... + CO2 → Na2CO3 + H2O.
Hướng dẫn giải:
a) 2Fe(OH)3  Fe2O3 + 3H2O;
b) H2SO4 + 2NaOH → Na2SO4 + 2H2O;
c) H2SO4 + Zn(OH)2 → ZnSO4 + 2H2O;
d) NaOH + HCl → NaCl + H2O;
e) 2NaOH + CO2 → Na2CO3 + H2O.
Bài 4: Dẫn từ từ 1,568 lít khí CO2 (đktc) vào một dung dịch có hòa tan 6,4g NaOH.
a) Hãy xác định khối lượng muối thu được sau phản ứng.
b) Chất nào đã lấy dư và dư là bao nhiêu (lít hoặc gam)?
Hướng dẫn giải:
a) Số mol CO2 = 1,568 : 22,4 = 0,07(mol)
Số mol NaOH = 6,4 : 40 = 0,16 (mol)
2NaOH + CO2 → Na2CO3 + H2O.
0,14mol 0,07mol 0,07mol
Khối lượng muối thu được sau phản ứng là:
0,07 x 106 = 7,42(gam).
b) Chất dư là NaỌH
Số mol NaOH dư là 0,16 - 0,14 = 0,02(mol)
Khối lượng NaOH dư là 0,02 x 40 = 0,8 (gam)
B. Canxi hiđroxit – thang PH
Bài 1: Viết các phương trình hóa học thực hiện chuyển đổi hóa học sau:
Fe2O3 + 3H2O;
b) H2SO4 + 2NaOH → Na2SO4 + 2H2O;
c) H2SO4 + Zn(OH)2 → ZnSO4 + 2H2O;
d) NaOH + HCl → NaCl + H2O;
e) 2NaOH + CO2 → Na2CO3 + H2O.
Bài 4: Dẫn từ từ 1,568 lít khí CO2 (đktc) vào một dung dịch có hòa tan 6,4g NaOH.
a) Hãy xác định khối lượng muối thu được sau phản ứng.
b) Chất nào đã lấy dư và dư là bao nhiêu (lít hoặc gam)?
Hướng dẫn giải:
a) Số mol CO2 = 1,568 : 22,4 = 0,07(mol)
Số mol NaOH = 6,4 : 40 = 0,16 (mol)
2NaOH + CO2 → Na2CO3 + H2O.
0,14mol 0,07mol 0,07mol
Khối lượng muối thu được sau phản ứng là:
0,07 x 106 = 7,42(gam).
b) Chất dư là NaỌH
Số mol NaOH dư là 0,16 - 0,14 = 0,02(mol)
Khối lượng NaOH dư là 0,02 x 40 = 0,8 (gam)
B. Canxi hiđroxit – thang PH
Bài 1: Viết các phương trình hóa học thực hiện chuyển đổi hóa học sau:
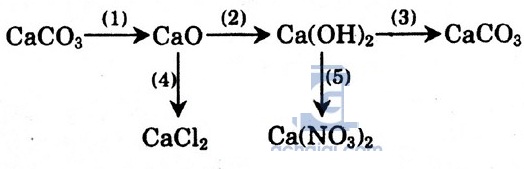 Hướng dẫn giải:
CaCO3
Hướng dẫn giải:
CaCO3  CaO + CO2↑ (1)
CaO + H2O → Ca(OH)2 (2)
Ca(OH)2 + CO2 → CaCO3↓ + H2O (3)
CaO + 2HCl → CaCl2 + H2O (4)
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O (5)
Bài 2. Có ba lọ không nhãn, mỗi lọ đựng một chất rắn màu trắng CaCO3, CaO, Ca(OH)2. Hãy nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình phản ứng hóa học.
Hướng dẫn giải:
Dùng nước để thử 3 mẫu trong 3 ống nghiệm.
Chất rắn không tan trong nước là CaCO3.
Chất rắn tan trong nước nhưng ống nghiệm không nóng lên là Ca(OH)2.
CaO + CO2↑ (1)
CaO + H2O → Ca(OH)2 (2)
Ca(OH)2 + CO2 → CaCO3↓ + H2O (3)
CaO + 2HCl → CaCl2 + H2O (4)
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O (5)
Bài 2. Có ba lọ không nhãn, mỗi lọ đựng một chất rắn màu trắng CaCO3, CaO, Ca(OH)2. Hãy nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình phản ứng hóa học.
Hướng dẫn giải:
Dùng nước để thử 3 mẫu trong 3 ống nghiệm.
Chất rắn không tan trong nước là CaCO3.
Chất rắn tan trong nước nhưng ống nghiệm không nóng lên là Ca(OH)2.
Chất rắn tan trong nước, ống nghiệm nóng lên là CaO.
CaO + H2O → Ca(OH)2
Phản ứng tỏa nhiệt làm nước sôi và ống nghiệm nóng lên.
Bài 3. Hãy viết các phương trình hóa học khi có dung dịch NaOH tác dụng với dung dịch H2SO4 tạo ra:
a) Muối axit b) Muối trung hòa.
Hướng dẫn giải:
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Bài 4. Một dung dịch bão hòa khí CO2 trong nước có pH = 5. Hãy giải thích và viết phương trình hóa học của CO2 với nước.
Hướng dẫn giải:
Vì tạo thành dung dịch axit H2CO3
CO2 + H2O → H2CO3
© Bản quyền thuộc về
Bài kiểm tra. Ghi rõ nguồn Bài kiểm tra.com khi sao chép nội dung này.

